
科目: 来源: 题型:
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所
示:

原子序数
下列说法不正确的是( )
A. x、z、d三种元素能形成具有强氧化性的酸
B. 根据g、h的单质与Fe反应的情况,可以判断h的非金属性大于g
C. 工业上通过电解f、h形成的化合物制取f 单质
D. x与其他元素可形成共价化合物或离子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】锂(Li)—空气电池的工作原理如图所示下列说法不正确的是

A. 金属锂作负极,发生氧化反应
B. Li+通过有机电解质向水溶液处移动
C. 正极的电极反应:O2+4e—==2O2—
D. 电池总反应:4Li+O2+2H2O==4LiOH
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.某课外小组利用干燥纯净H2还原黄色的WO3粉末并测定W的相对原子质量,如图是测定装置的示意图,A中的试剂是盐酸。
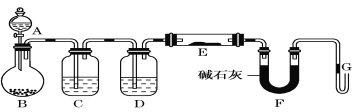
请回答下列问题。
(1)仪器B的名称是_____________。
(2)连接好装置后应首先检查气密性,其方法是____________________。
(3)检查气密性后,下列实验操作的先后顺序是(填字母)__________________。
a.加热玻璃管 b.从A瓶逐滴滴加液体 c. A瓶停止滴加液体
d.停止加热 e.检验氢气纯度
(4)已知取用WO3质量为a克,F的U形管实验前后质量分别为b克、c克,则钨的相对分子质量用字母表示为___________________________。
Ⅱ.探究AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体NO2(可以被碱完全吸收),在装置D中收集到无色气体。当反应结束后,试管中残留固体为黑色银单质。

(5)给A中试管加热的方法是____________________。
(6)没有装置B可能出现的现象___________________________。
(7)有同学提出可以把B、C换成一个简单的装置,你认为可以是____________。
(8)同学们根据氧化还原反应知识讨论可以得出D中收集的气体成分。用实验证明该气体的方法是______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮可以形成多种离子和分子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
(1)写出N2H62+中共价键的类型除极性键,非极性键外再写出一种__________。
(2)下列关于NH2-的说法合理的是____________________(填字母)。
A.H-N-H夹角109.5° B. H-N-H夹角180° C. H-N-H夹角大约105°
D.中心原子的杂化轨道为四面体形 E. 该离子为V形 F.易与H+结合
(3)写出N3-的等电子体且是中性分子的化学式___________________(一种)。
(4)N2H4名称是肼,也叫联氨,通常为无色油状发烟液体,有吸湿性,有氨的臭味。可作为火箭的燃料。其沸点比氨气高的主要原因是________________________。
利用含N的铜萃取剂M可通过如下反应实现铜离子的富集:
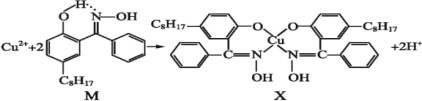
(5)X难溶于水、易溶于有机溶剂,X中配位原子是______。
(6)M中氮原子以_______杂化轨道与氧原子形成σ键。
(7)M与W(如图)是同分异构体,则在水中溶解度较大的物质是___(填字母M或W)。

(8)常用![]() 表示分子中的大π键,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,例如苯分子中的大π键可表示为
表示分子中的大π键,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,例如苯分子中的大π键可表示为![]() 。吡咯(如图)中的各个原子均在同一平面内且吡咯分子中也含有大π键,已知氮原子有一对未参与杂化的电子占据p轨道,吡咯分子中的大π键应表示为________。
。吡咯(如图)中的各个原子均在同一平面内且吡咯分子中也含有大π键,已知氮原子有一对未参与杂化的电子占据p轨道,吡咯分子中的大π键应表示为________。
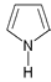
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学通过如下流程制备氧化亚铜:

已知CuCl难溶于水和稀硫酸:Cu2O+2H+==Cu2++Cu+H2O
下列说法不正确的是
A. 步骤②SO2可用Na2SO3替换
B. 步骤③中为防止CuCl被氧化,可用SO2水溶液洗涤
C. 步骤④发生反应的离子方程式为2CuCl+2OH-=Cu2O+2Cl-+H2O
D. 如果Cu2O试样中混有CuCl和CuO杂质,用足量稀硫酸与Cu2O试样充分反应,根据反应前、后固体质量可计算试样纯度
查看答案和解析>>
科目: 来源: 题型:
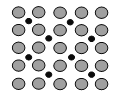
【题目】(1)诺贝尔化学奖获得者Gerhard Ertl利用光电子能谱证实:洁净铁(可用于合成氨反应的催化剂)的表面上存在氮原子,图为氮原子在铁的晶面上的单层附着局部示意图(图中小的黑色球代表氮原子,大的灰色球代表铁原子)。则在图示状况下,铁颗粒表面上N/Fe原子数比值的最大值为________________。
(2)Cu与O形成的某种化合物X,其晶胞结构如下图所示。O在顶点和体心。已知X晶胞中原子坐标参数:A为(0,0,0),B为(![]() ,
,![]() ,
,![]() ),则C原子的坐标参数为___________。
),则C原子的坐标参数为___________。
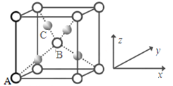
物质结构用到多种模型,请结合模型完成下列问题:
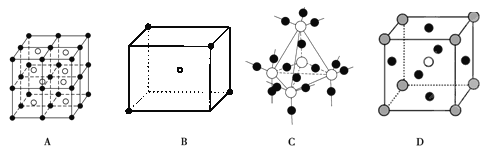
(3)D图是CaTiO3晶胞模型,同一种微粒位置相同,Ca2+位于立方体的体心,则Ti4+位于____(填顶点或面心)
(4)已知A图是CsCl晶胞模型,体心为Cs+,与其紧邻等距离的Cs+数目有___________个。
(5)某分子中原子空间位置关系如B图所示,X位于立方体的顶点,Y位于立方体中心,用X,Y表示的化学式为______________。
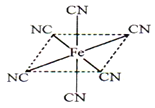
(6)铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其阴离子结构如图。写出上述沉淀溶解过程的离子方程式为___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 《元丰行示德逢》里“雷蟠电掣云滔滔,夜半载雨输亭皋”涉及化学反应N2+O2![]() 2NO
2NO
B. 检验久置 Na2SO3是否变质,可用BaCl2溶液和稀硝酸
C. SO2通入BaCl2溶液中会产生白色沉淀
D. 将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化
查看答案和解析>>
科目: 来源: 题型:
【题目】金、银、铝、镁、钛,均是人类大量生产和使用的金属。试回答下列问题:
(1)一个原子有多级电离能,从电子排布特点判断第三电离能大小:Mg______Al(填大于或等于或小于)。
(2)钛被称为继铁、铝之后的第三金属。第四周期元素中,未成对电子数目与基态钛原子未成对电子数目相同元素还有__________种。
(3)基态金原子的外围电子排布式为5d106s1,试判断金在元素周期表中的位置_______。
(4)Ag+与氨水形成的二氨合银离子空间构型是直线形,其中配位原子的杂化类型是______。
(5)四氯化钛是生产金属钛及其化合物的重要中间体。室温下,四氯化钛为无色液体,能与水蒸气反应发烟,生成二氧化钛固体,可以做烟幕剂。四氯化钛中存在的化学键类型是_______,写出上述反应的化学方程式____________________。
(6)工业用电解氯化镁制得镁,而不用氧化镁的原因___________________________。
(7)金单质的晶胞是面心立方结构,已知金相对原子质量为M,晶胞边长为d cm,则一个该晶胞占有的原子总质量为________克。
查看答案和解析>>
科目: 来源: 题型:
【题目】合理使用食品添加剂既不会影响人体健康,又能有效改善食物品质和色、香、味,但有 些物质严禁用作食品添加剂.下列做法正确的是( )
A.二氧化硫用作银耳的漂白剂B.胡萝卜素用作饮料的调味剂
C.次氯酸钠用作饼干的膨松剂D.苯甲酸钠用作火腿肠的防腐剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com