
科目: 来源: 题型:
【题目】下列各组离子在酸性溶液中能大量共存且溶液呈无色透明的是
A.K+、Na+、SiO32-、Br-B.Na+、K+、CH3COO-、NO3-
C.K+、Cl-、Fe3+、SO42-D.Mg2+、Al3+、Cl-、NO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
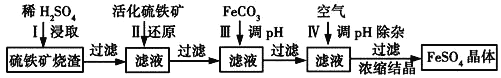
活化硫铁矿的主要成份是FeS2。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是_______________________________。
(2)第Ⅱ步中硫铁矿中的S被氧化到最高价态,相应的离子方程式为______________________。
(3)第Ⅱ步中检验Fe3+是否被完全还原的实验方法是____________________________________。
(4)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质被除尽。通入空气引起溶液pH降低的原因是_________________________。
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2===Fe+2Li2S,正极反应式是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,两种碳酸盐MCO3(M分别为A和B两种离子)的沉淀溶解平衡曲线如图所示。已知:pM=lgc(M),p(CO32)=lgc(CO32)。已知ACO3比BCO3溶解度更大。(不考虑阴阳离子的水解)。下列说法正确的是

A. 线a表示ACO3的溶解平衡曲线
B. 该温度下,向ACO3的饱和溶液中加入Na2CO3溶液,一定能产生沉淀
C. 向0.1L 1mol/L的BCl2溶液中加入Na2CO3固体,当加入Na2CO3固体的质量为116.6g时,B2+离子恰好沉淀完全(B2+离子为10—5mol/L时认为沉淀完全)
D. ACO3的Ksp=10—4.4
查看答案和解析>>
科目: 来源: 题型:
【题目】一种光化学电池的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)![]() Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法正确的是( )
Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法正确的是( )
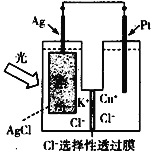
A. Cl-由负极区向正极区迁移
B. Ag为负极,Pt为正极
C. Cu+在Pt电极表面发生氧化反应
D. Ag极的电极反应为Ag-4e-+Cl-![]() AgCl
AgCl
查看答案和解析>>
科目: 来源: 题型:
【题目】根据题中信息完成下列填空题
(1)黄绿色气体单质X,与标况下密度为1.25g/L的烯烃Y发生加成反应,请写出烯烃Y的结构式__________。写出该加成产物的所有同分异构体结构简式______________。
(2)125℃,101kPa的条件下,某气态烯烃在氧气中充分燃烧后,气体体积没有变化,求出该烯烃的分子式________。
(3)某元素X的一种核素质量数为A,含N个中子,它与1H原子组成HmX分子。在a g HmX中所含质子的物质的量是___________mol。
(4)E和F均含有18个电子的微粒,E是所有18电子微粒中氧化能力最强的分子,请你写出E与水发生的化学反应方程式_______________。F是有两种元素组成的三原子分子,将其通入足量的NaOH溶液,发生的离子方程式_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用太阳光分解水制氢是未来解决能源危机的理想方法之一。某研究小组设计了如下图所示的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,下列说法正确的是( )
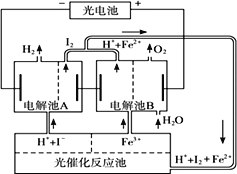
A. 反应体系中I2和Fe2+可循环使用
B. 光电池是原电池
C. 光催化反应池中的反应方程式为:2I—+2Fe3+ ![]() I2+2Fe2+
I2+2Fe2+
D. 进入电解池B的溶液与从电解池B排出的溶液pH相同
查看答案和解析>>
科目: 来源: 题型:
【题目】NH4Cl溶于重水(D2O)后,溶液中存在的一水合氨和水合氢离子可能是( )
A.NH3HDO和D3O+B.NH3HDO和HD2O+C.NH3H2O和H2DO+D.以上都有可能
查看答案和解析>>
科目: 来源: 题型:
【题目】能正确表示下列化学反应的离子方程式是( )
A. 氯气溶于水:Cl2 + H2O = 2H+ + Cl-+ ClO-
B. 用碳酸钠溶液吸收少量二氧化硫:![]() =
= ![]()
C. NaClO溶液与FeCl2溶液混合:Fe2+ + 2ClO- + 2H2O = Fe(OH)2↓ + 2HClO
D. NaHSO4溶液与Ba(OH)2溶液反应至中性: H++SO42—+Ba2++OH— = BaSO4↓+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学称取9.00g淀粉溶于水,测定淀粉的水解百分率.其程序如下:
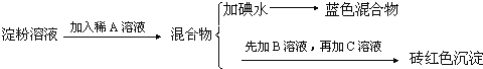
试回答下列问题:
(1)各步加入的试剂为:A_________,B_________,C_________;
(2)加入A溶液而不加入B溶液是否可以_________,其理由是_________;
(3)写出淀粉水解的方程式_________;
(4)当析出1.44g砖红色沉淀时,淀粉水解率是_________;[已知葡萄糖与Cu(OH)2反应的化学方程式为:CH2OH(CHOH)4CHO+2Cu(OH)2![]() CH2OH(CHOH)4COOH+Cu2O↓+2H2O]。
CH2OH(CHOH)4COOH+Cu2O↓+2H2O]。
查看答案和解析>>
科目: 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表
元素代号 | X | Y | Z | M | R | w |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 | 0.077 |
主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 | +4 -4 |
已知:X是短周期中最活泼的金属,且与R同周期。请用相应的化学用语或者化学符号回答下列问题。
(1)R在元素周期表中的位置为________________。
(2)X与M按原子个数比1:1构成的物质的电子式为_____________;所含化学键类型___________。
(3)X+、Y2-、M2-、R3+离子半径大小顺序为__________________________(用离子符号表示)。
(4)请用电子式表示WY2的形成过程___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com