
科目: 来源: 题型:
【题目】某温度时,在3L密闭容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据

(1)该反应的化学方程式为:______
(2)反应开始至2min,用X表示的平均反应速率为:______;平衡时,Y的转化率为______;平衡时,Y的浓度为______;
(3)在密闭容器里,通入a mol X(s)和b mol Y(g),发生反应X(s)+Y (g)2Z(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”、“减小”或“不变”)
①增加X(s)的质量:______
②增大容器的体积:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质:(用序号填空)
① O2和O3 ; ②12C 与14C; ③ CH3 (CH2) 3 CH3和![]()
④ 和
和![]() ;
;
(1)互为同位素的是_______ ;(2)互为同素异形体的是________;
(3)互为同分异构体的是________;(4)属于同一物质的是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】把下列四种盐酸溶液分别加入四个盛有20 mL 1 mol/L的KOH溶液的烧杯中,此时反应最快的是( )
A. 20℃ 20 mL 3 mol/L的盐酸B. 25℃ 30 mL 2 mol/L的盐酸
C. 25℃ 10 mL 5 mol/L的盐酸D. 20℃ 10 mL 2 mol/L的盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】十九大报告中指出“持续实施大气污染防治行动,打赢蓝天保卫战”。SO2为大气污染物,研究它的性质对治理具有重要意义。在铝基氧化铜作催化剂时,可利用天然气脱除二氧化硫,并回收单质硫(熔点为112.8℃,沸点为444.6℃)。
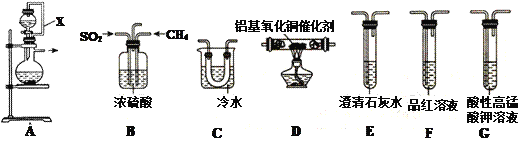
(1)①装置中导管X的作用是:______________________________。
②用装置A制取SO2,则试剂的组合最好是_________(填字母)。
a. 18.4 mol/L H2SO4+Cu b. 4 mol/L HNO3+Na2SO3 c. 60% H2SO4+K2SO3
③水与Al4C3在装置A中制取甲烷,其化学方程式为:________________。
(2)利用制得的CH4和SO2并结合B~G装置验证反应:CH4+2SO2 .![]() 2S+CO2+2H2O生成的单质S和CO2。
2S+CO2+2H2O生成的单质S和CO2。
①B装置有三个作用,分别是________________________、充分混合CH4和SO2、观察气泡以便调节CH4和SO2的流速比约为1∶2。
②实验装置依次连接的合理顺序为B、_____________________(每个装置只用一次)。
③证明有CO2产生的现象为_____________________________。
④G装置中发生反应的离子方程式为_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】活性炭可处理大气污染物NO。T℃时,在1L密闭容器中加入NO气体和炭粉,发生反应生成两种气体A和B,测得各物质的物质的量如下:
活性炭/mol | NO/mol | A/mol | B/mol | |
起始状态 | 2.030 | 0.100 | 0 | 0 |
2 min时 | 2.000 | 0.040 | 0.030 | 0.030 |
(1)2 min内,用NO表示该反应的平均速率v(NO)= mol·L-1·min-1;
(2)该反应的化学方程式是________________________________________;
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是_____ 。
①v(NO)∶v(A)∶v(B)=2∶1∶1
②混合气体的密度不再改变
③总压强不再改变
④混合气体的平均相对分子质量不再改变
(4)碳元素可形成数量众多,分布极广的有机化合物,其中甲醇是常见的燃料,甲醇燃料电池的结构示意图如下,一极通入甲醇,另外一极通入氧气;电解质溶液是稀硫酸,电池工作时总反应式:2CH3OH+3O2=2CO2+4H2O。
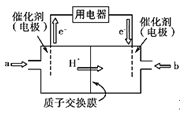
①a处通入的物质是____,电极反应式为:______;
②b处电极反应式为_________________________;
③电池工作时H+由 极移向 极(填正、负极)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:A是石油裂解气的主要产物之一,其产量常用于衡量一个石油化工发展水平的标志。下列是有机物A~G之间的转化关系:

请回答下列问题:
(1)A的官能团的名称是____________。C的结构简式是____________。
(2)E是一种具有香味的液体,由B + D→的反应方程式为:____________。该反应类型是____________。
(3)G是一种高分子化合物,其名称是____________,链节是____________。
(4)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质F(沸点12.27OC)进行应急处理。写出由A制F的化学反应方程式:____________。决定F能用于冷冻麻醉应急处理的性质是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高氯酸钾是一种白色粉末,可用作发烟剂、引火剂、氧化剂和化学分析试剂,医药工业用作解热和利尿等药剂。用PbO2来制备KClO4的工业流程如下:

(1)如图过滤装置中有两处明显错误,一处是未用玻璃棒引流,另一处是__。

(2)写出NaClO3与PbO2反应的离子方程式_______________
(3)工业上可以利用滤液Ⅰ与KNO3发生反应制备KClO4的原因是______________
(4)用电解法也可以制备KClO4,在无隔膜、微酸性条件下,电解食盐水得到NaClO3溶液,再通过一系列转化和操作得到产品。
I.写出电解食盐水阳极电极反应式:______________________________
II.该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验:准确称取5.7635 g样品溶于水中,配成250 mL溶液,从中取出25.00 mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl-,反应为:
3KClO4+C6H12O6=6H2O+6CO2↑+3KCl,加入少量K2CrO4溶液作指示剂,用0.20mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积21.50 mL。滴定达到终点时,产生砖红色Ag2CrO4沉淀。
①已知:Ksp(AgCl)=1.8×l0-10,Ksp(Ag2CrO4)=1.1×10-12,若终点时c(Cl-)=1.8×10-6 mol·L-1,则此时c(CrO42-)=______________mol·L-1。
②KClO4样品的纯度为______________。(精确到0.01%)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。通过对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
(1)已知:H2的燃烧热为285.8 kJ·mol-1 H2O(g)=H2O(l) ΔH=-44 kJ/mol
N2(g)+2O2(g)=2NO2(g) ΔH=+133 kJ/mol
①在催化剂存在下,H2还原NO2生成水蒸气和另一种无毒物质的热化学方程式为:___________________________________。
②反应2NO2(g )=N2(g)+2O2(g),设起始时容器中只有NO2,平衡时三种物质的物质的量与温度关系如图所示。

则A点时,NO2的转化率为_______________。
B点时,设容器的总压为a Pa,则平衡常数Kp为____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)向2 L密闭容器中加入2 mol CO2和6 mol H2,在适当的催化剂作用下,下列反应能自发进行:CO2(g)+3H2(g)![]() CH3OH(g) +H2O(g)。
CH3OH(g) +H2O(g)。
①该反应ΔH_______0(填“>”、“<”或“=”)
②下列叙述能说明此反应达到平衡状态的是____________。(填字母)
a.混合气体的平均相对分子质量保持不变
b.1 mol CO2生成的同时有3 mol H—H键断裂
c.CO2的转化率和H2的转化率相等
d.混合气体的密度保持不变
③反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在起始温度(T1℃)、体积相同(2L)的两密闭容器中,改变条件,反应过程中部分数据见下表:
CH3OH(g)+H2O(g),在起始温度(T1℃)、体积相同(2L)的两密闭容器中,改变条件,反应过程中部分数据见下表:
反应时间 | CO2/mol | H2/mol | CH3OH/mol | H2O/mol | |
反应Ⅰ:恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
10 min | 4.5 | ||||
20 min | 1 | ||||
30 min | 1 | ||||
反应Ⅱ:绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
反应Ⅰ,前10min内的平均反应速率v(CH3OH)=____________。达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)____________K(II)(填“>”、“<”或“=”);平衡时CH3OH的浓度c(I)____________c(II)(填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出CH4和Cl2在光照的条件下生成CH3Cl的化学反应方程式_________
(2)写出如图所示原电池的电极方程式:

负极:_______________________
正极:_______________________
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如图填空:

(1)反应物是______________,生成物是______________。
(2)在2 min内用A、B、C表示的化学反应速率分别为____________、____________、____________。
(3)该反应的化学方程式是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com