
科目: 来源: 题型:
【题目】应用电化学原理,回答下列问题:
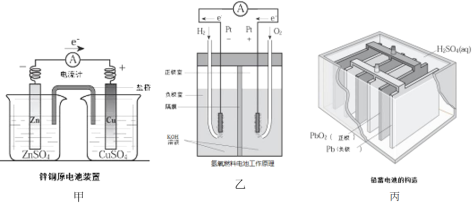
(1)上述三个装置中,负极反应物化学性质上的共同特点是_________。
(2)甲中电流计指针偏移时,盐桥(装有含琼胶的KCl饱和溶液)中离子移动的方向是________。
(3)乙中正极反应式为________;若将H2换成CH4,则负极反应式为_______。
(4)丙中铅蓄电池放电一段时间后,进行充电时,要将外接电源的负极与铅蓄电池______极相连接。
(5)应用原电池反应可以探究氧化还原反应进行的方向和程度。按下图连接装置并加入药品(盐桥中的物质不参与反应),进行实验:
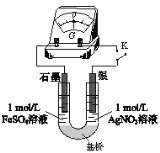
ⅰ.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
ⅱ.随后向U型管左侧逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
① 实验ⅰ中银作______极。
② 综合实验ⅰ、ⅱ的现象,得出Ag+和Fe2+反应的离子方程式是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】要“持续实施大气污染防治行动,打赢蓝天保卫战。”下列措施不利于“打赢蓝天保卫战”的是
A.推广燃煤脱硫技术,防治SO2污染B.推广使用共享单车,倡导绿色出行
C.研制电动汽车,逐步取代燃油汽车D.加快石油开采速度,加大化石能源供应
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)室温下,使用pH计测定0.1 mol/LNH4Cl溶液的pH=5.12。由此可以得到的结论是_______(填字母)。
a.溶液中c(H+)>c(OH-)
b.NH4+水解是微弱的
c.NH3·H2O是弱碱
d.由H2O电离出的c(H+)<10-7 mol/L
e.物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7
(2)室温下,用0.1 mol/LNaOH溶液分别滴定20.00 mL 0.1 mol/L的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是

①表示滴定盐酸的曲线是_______(填序号)。
②滴定醋酸溶液的过程中:
ⅰ.V(NaOH)=10.00 mL时,溶液中离子浓度由大到小的顺序为_________。
ⅱ.当c(Na+)=c(CH3COO—)+c(CH3COOH)时,溶液pH____7(填“>”、“=”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g)+O2(g)![]() 2NO(g) ΔH=+183 kJ/mol
2NO(g) ΔH=+183 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=-1164.4 kJ/mol
则N2(g)+3H2(g)![]() 2NH3(g) ΔH=______kJ/mol
2NH3(g) ΔH=______kJ/mol
(2)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料Ⅰ | 1.0 mol/L | 3.0 mol /L | 0 |
投料Ⅱ | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
①按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数表达式为_______。
②按投料Ⅱ进行反应,起始时反应进行的方向为________(填“正向”或“逆向”)。
③若升高温度,则合成氨反应的化学平衡常数________(填“变大”、“变小”或“不变”)。
④L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。
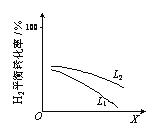
ⅰ X代表的物理量是______。
ⅱ 判断L1、L2的大小关系,并简述理由______。
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:
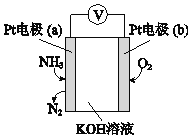
①电极b上发生的是______反应(填“氧化”或“还原”)。
②写出电极a的电极反应式_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以锂辉石为原料生产碳酸锂的部分工业流程如下:

已知:①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量FeO、MgO等。
②Li2O·Al2O3·4SiO2+H2SO4![]() Li2SO4+Al2O3·4SiO2·H2O
Li2SO4+Al2O3·4SiO2·H2O
③某些物质的溶解度(S)如下表所示。
T℃ | 20 | 40 | 60 | 80 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
④Fe3+完全沉淀时pH为3.4
(1)为提高原料浸出速率,除升高温度外还可采取的措施是__________(任写一条)。
(2)在滤液1中加入H2O2的目的是__________(用离子方程式表示);调节pH最佳试剂是__________(填序号 )。
A.CuO B.CuCO3 C.MgO D.NH3·H2O
(3)从滤渣中分离出Al2O3的流程如下图所示,请写出生成沉淀的离子方程式__________。
![]()
(4)向滤液2中加入Na2CO3溶液的作用是__________。
(5)“过滤、热水洗涤”步骤中,“热水洗涤”的原因是__________;证明沉淀已洗净的操作是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效漂白剂,某小组利用下列装置制备NaClO2,并对其样品进行分析,查阅资料知:NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2,高于60℃时析出NaClO2会分解。
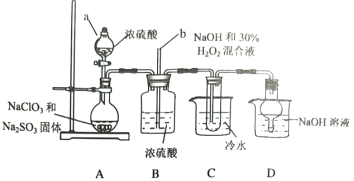
(1)仪器a的名称是__________;长玻璃导管b的作用是__________;装置D的作用是__________。
(2)装置A用于制备ClO2,理论上所加NaClO3和Na2SO3固体的物质的量之比是__________。
装置C中发生的离子方程式是__________。
(3)为提取NaClO2固体,试管中产品需蒸发结晶、过滤、洗涤,洗涤用水的温度范围是__________。
(4)称取Wg的产品配成250mL溶液,取25.00mL溶液,加足量KI和稀H2SO4,以①__________溶液作指示剂,用cmol·L-1Na2S2O3标准液滴定至终点(I2+2S2O32-=2I-+S4O62-),判断滴定终点的现象是②_________;若消耗标准溶液体积的平均值是VmL,则产品中NaClO2的质量分数是③__________%。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关酸雨的说法不正确的是( )
A. 空气中的SO2溶于水,最终形成酸雨
B. NO2或SO2都会导致酸雨的形成
C. pH<7的雨水不都是酸雨
D. 工业废水任意排放是造成酸雨的主要原因
查看答案和解析>>
科目: 来源: 题型:
【题目】
金属铁及其化合物在材料、航空工业上有重要用途。回答下列相关问题:
(1)基态钛原子中有__________个状态不同的电子,最高能层电子的电子云轮廓图形状为__________,写出其价电子的轨道表达式__________。
(2)化合物TiO2不仅是常用的白色颜料,也是一些反应的良好催化剂,如:
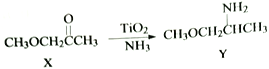
有机物X中C原子的杂化轨道类型为__________,1mol Y中所含σ键的数目是__________。
(3)已知TiCl4在常温下是无色液体,TiCl4的晶体类型是__________晶体,其空间构型是__________。
(4)自然界中有丰富的钛矿资源,如右图表示的是钡钛矿晶体的晶胞结构,经X射线分析,该晶胞为正方体,晶胞参数为apm。
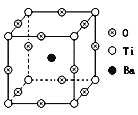
写出钡钛矿晶体的化学式__________,其密度是__________g·cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】党的十九大报告中提出要建设美丽中国,推进绿色发展。燃煤烟气(污染气体包括NOx、CO、SO2等)的综合治理是解决大气污染的主要途径。
(1)用CH4催化还原氮氧化物可以消除其污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol-1
③H2O(g)=H2O(1)△H=-44.0kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式__________。
(2)选择合适的催化剂,在一定条件下可对部分燃煤烟气回收,其主要反应是:2CO(g)+SO2(g)![]() 2CO2(g)+S(1)△H=-270kJ·mol-1
2CO2(g)+S(1)△H=-270kJ·mol-1
①其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图1,Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是__________。
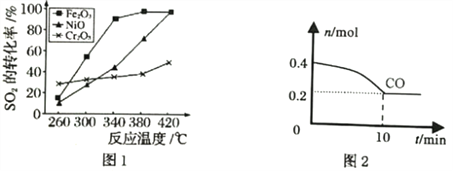
②T℃Fe2O3催化作用下,将等物质的量的CO和SO2充入容积为2L的密闭容器中,保持温度和体积不变,反应过程中CO的物质的量随时间变化如图2所示。10min内该反应的速率v(SO2)=________;T℃时该化学反应的平衡常数K=______;保持容积固定,若升高温度,反应的平衡常数_________(填“增大”“减小”或“不变”,下同),容器内混合气体的密度__________。
(3) 图3是用食盐水做电解液电解烟气脱氮的原理图,NO被阳极产生的氧化性物质氧化为NO3-,尾气经NaOH溶液吸收排入空气。
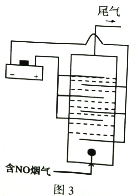
①NO被氧化的离子方程式是__________。
②若通入的烟气2240L(标准状况),烟气中NO含量为15%,(假设烟气中无其他含氮气体),测得溶液中含有NO3-的物质的量为1.47mol,则NO除去率为__________%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com