
科目: 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的短周期元素,已知A、B、D三种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4。
(1)写出下列元素符号: B________,D________。
(2)A与D两元素可形成化合物,用电子式表示其化合物的形成过程:________。
(3)A在空气中燃烧生成原子个数比为1:1的化合物,写出其电子式为________。
(4)元素C的最高价氧化物与元素A的最高价氧化物的水化物反应的离子方程式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)Mo可被发烟硝酸氧化,产物MoOF4和MoO2F2物质的量比为1∶1,完成下列方程式:____Mo+____HF+____HNO3=____ MoO2F2+____ MoOF4+____NO2↑+____ _________
(2)已知:①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s) +2O2(g)=Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ΔH3
则ΔH3 =_________(用含ΔH1、ΔH2的代数式表示),在反应③中若有0.2mol MoS2参加反应,则转移电子_______________mol。
(3)密闭容器中用Na2CO3(S)作固硫剂,同时用一定量的氢气还原辉钼矿(MoS2)的原理是:MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
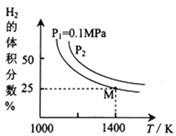
①由图可知,该反应的ΔH__0(填“>”或“<”);P2__________0.1MPa(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是______(选填编号)。
A.v正(H2)=v逆(H2O)
B.再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为____(计算结果保留0.1%)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数Kp=______(MPa)2
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
实验 序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | 6 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t1 |
(1)通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1=_________,T1=_______;通过实验___________可探究出温度变化对化学反应速率的影响。
(2)C组实验中液褪色时间t1______(填“>”或“<”)8s,C组实验的反应速率v(KMnO4) = _________________。(用含有t1的式子表示)
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并以此分析造成n(Mn2+)突变的可能的原因是:______________。

查看答案和解析>>
科目: 来源: 题型:
【题目】黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用做食盐添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为10mg·kg-1。一种制备黄血盐的工艺如下:

回答下列问题:
(1)步骤Ⅰ反应的化学方程式为_____________________________。
(2)步骤Ⅳ过滤所得的废液中含量较多的溶质为_______________________。(填化学式)
(3)步骤Ⅴ所用的试剂X是_________________。
(4)工艺中用到剧毒的HCN 溶液,含CN-的废水必须处理后才能排放。己知氢氰酸是一种具有苦杏仁特殊气味的无色剧毒液体,易挥发,25℃时,Ka(HCN)=6.25×10-10。
①NaCN 的电子式为_________________,反应CNˉ +H2O![]() HCN+OHˉ在25℃时的平衡常数 K= _________________。(填数值)
HCN+OHˉ在25℃时的平衡常数 K= _________________。(填数值)
②处理含CN-废水的方法是:第一步控制pH>10,用NaClO溶液先将CN-“不完全氧化”为OCN-;第二步控制 pH为7.5~8.5,用NaClO“不完全氧化”OCNˉ生生成N2和两种盐。
第一步控制强碱性的主要目的是__________________________________。
第二步反应的离子方程式为______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将气体A、B置干容积为2L的密用容器中发生如下反应:4A(g)+B(g)![]() 2C (g),反皮进行到4s末,测得A、B、C的物质的量分别为0.5mol、0.4mol、0.2mol。则用反应物B表示该反应的速率为
2C (g),反皮进行到4s末,测得A、B、C的物质的量分别为0.5mol、0.4mol、0.2mol。则用反应物B表示该反应的速率为
A. 0.025mol·L-1·s-1c. B. 0.0125 mol·L-1·s-1
C. 0.05 mol·L-1·s-1 D. 0.1 mol·L-1·s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2是一种高效水处理剂,实验室通过以下反应制得ClO2: 2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O,关于此反应的说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O,关于此反应的说法正确的是
A. KClO3发生化合价降低,失电子
B. 反应中H2SO4体现了酸性和强氧化性
C. 反应中H2C2O4被氧化
D. 产物中Cl与C化合价相同,因而氧化性一样强
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对于可逆反应2A(g)+B(g)![]() 2C(g) +3D(g)达到平衡时的说法正确的是
2C(g) +3D(g)达到平衡时的说法正确的是
A. A、B全部转化成了C、DB. 反应已经停止
C. 反应混合物中各组分的浓度不再改变D. v (C)∶v(D)=2∶3
查看答案和解析>>
科目: 来源: 题型:
【题目】反应mA(s)+nB(g)![]() pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
①m+n>p ②x点表示的正反应速率大于逆反应速率
③x点比y点时的反应速率慢 ④n>p
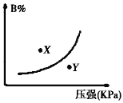
A. ①② B. ②④ C. ②③ D. ①③
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下的定容密闭容器中,进行可逆反应:A(s)+2B(g)![]() C(g)+D(g),当下列物理量不发生变化时: ①混合气体的密度 ②容器内气体的压强 ③混合气体的平均相对分子质量 ④B的物质的量浓度。则能表明该反应一定已达到平衡状态的是( )
C(g)+D(g),当下列物理量不发生变化时: ①混合气体的密度 ②容器内气体的压强 ③混合气体的平均相对分子质量 ④B的物质的量浓度。则能表明该反应一定已达到平衡状态的是( )
A. 只有④ B. ②③ C. ②③④ D. ①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com