
科目: 来源: 题型:阅读理解
| 容器 | 起始时各物质的量 | 到达平衡时放出的热量(QkJ) | 平衡时SO2转化率 (X) | |||
| SO2(mol) | O2(mol) | SO3(mol) | N2 | |||
| 甲 | 2 | 1 | 0 | 0 | Q1 | X1 |
| 乙 | 1 | 0.5 | 0 | 0 | Q2=39.4 | X2 |
| 丙 | 1 | 0.5 | 0 | 1 | Q3 | X3 |
| 丁 | 1.8 | 0.9 | 0.2 | 0 | Q4 | X4 |
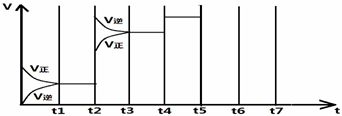
| t1-t2 | t3-t4 | t4-t5 | t6-t7 |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
| ||

查看答案和解析>>
科目: 来源: 题型:阅读理解

| ||
| ||

| 放电 |
| 充电 |
查看答案和解析>>
科目: 来源: 题型:
| 物质 | 氢气 | 一氧化碳 | 乙烷 | 乙烯 | 乙醇 |
| 化学式 | H2(g) | CO(g) | C2H6(g) | C2H4(g) | C2H5OH(l) |
| △H(kJ?mol-1) | -285.8 | -283.0 | -1559.8 | -1411.0 | -1366.8 |
查看答案和解析>>
科目: 来源: 题型:
| ① | ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||||
| ⑦ | ⑩ | |||||||||||||||||||
| ⑾ | ⑧ | ⑨ | ||||||||||||||||||
 Be(OH)2+2HCl
Be(OH)2+2HCl Be(OH)2+2HCl
Be(OH)2+2HCl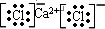
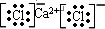
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com