
科目: 来源: 题型:
【题目】向体积为2L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应:2X(g) ![]() Y(g)+3Z(g)。
Y(g)+3Z(g)。
(1)经5min后达平衡,此时容器内压强为起始时的1.2倍,则用Y表示的速率为_____mol(L·min)。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一时间内测得的反应速率分别为:甲:ν(X)=3.5mol(L·min);乙:ν(Y)=2mol(L·min);丙:ν(Z)=4.5mol(L·min);丁:ν(X)=0.075mol(L·s)。若其他条件相同,温度不同,温度由高到低的顺序是(填序号)________________。
(3)若向达到(1)的平衡体系中充入氮气,则平衡向___(填“左”“右”或“不”,下同)移动。
(4)若在相同条件下向达到(1)所述平衡体系中再充入0.5molX气体,则平衡后X的转化率与(1)的平衡中X的转化率相比___。
A.无法确定 B.前者一定大于后者
C.前者一定等于后者 D.前者一定小于后者
查看答案和解析>>
科目: 来源: 题型:
【题目】某废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2常温下是深红棕色液体),设计了如下流程图:

已知:可供选择的试剂 a、试剂b(试剂 b代表一组试剂)如下:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2溶液(H+)、KMnO4溶液(H+)、稀盐酸。请根据流程图,回答相关问题:
(1)若试剂a为H2O2溶液(H+),已知H2O2 + 2KBr + 2HCl = Br2 + 2H2O + 2KCl
①发生反应的离子方程式为:__________;
②每消耗0.2molH2O2,反应转移的电子数为______mol;
③还原剂和还原产物的物质的量之比是_______;
(2)操作①②③④⑤对应的名称分别是:______、分液、_____、过滤、______ ;
(3)为了除去无色液体I中的Ca2+、Mg2+、SO42-,从可供选择的试剂中选出试剂b所代表的物质,按滴加顺序依次是____、____、____(填化学式);
(4)调pH=7是为了除去杂质离子________和_________,以提高氯化钾晶体的纯度;
(5)操作⑤中用到的瓷质仪器名称是_________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的短周期元素,A是短周期中金属性最强的元素,B是地壳中含量最高的金属元素,C单质的晶体是良好的半导体材料,D的最外层电子数与内层电子数之比为3:5。
(1)C的原子结构示意图为______,D在元素周期表中的位置______。
(2)A单质在氧气中燃烧生成化合物甲,甲中所含化学键为________;A单质在E单质中燃烧生成化合物乙,用电子式表示乙的形成过程__________________。
(3)F是中学化学常见元素,它的一种氧化物为红棕色粉末,B单质与其在高温条件下反应是冶炼F单质的方法之一,该反应的化学方程式为________________。
(4)E元素的非金属性强于D元素,用原子结构解释原因:同周期元素随着原子序数的递增,______________________________,非金属性增强。
(5)工业上将干燥的E单质通入D熔融的单质中可制得化合物D2E2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,该反应的化学方程式为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学对Cu的常见化合物的性质进行实验探究,研究的问题和过程如下:
(1)为探究Cu(OH)2是否和Al(OH)3一样具有两性,除选择Cu(OH)2外,必须选用的试剂为____________ (填序号) a.氨水 b.氢氧化钠溶液 c.稀硫酸 d.冰醋酸
(2)为探究不同价态铜的稳定性,进行如下实验:
①将CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末。
②向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为 ____________ 。
(3)为了探究氨气能否和氢气一样还原CuO,他根据所提供的下列装置进行实验(夹持装置未画),装置A产生氨气,按气流方向连接各仪器接口,顺序为a→___→___→___→___→___→___→h
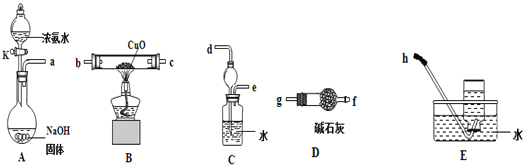
①实验开始时,打开分液漏斗的活塞K,发现浓氨水没有滴下,如果各仪器导管均没有堵塞,则可能的原因是_______________________________________。
②实验结束后,装置B中固体由黑色变为红色,装置E中收集到无色无味的气体,在空气中无颜色变化,点燃的镁条可以在其中燃烧,则B装置中发生的化学方程式为_____________________。
③装置C中的球形装置的作用是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为几种短周期元素的性质
元素符号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径10-1nm | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
最高或最低化合价 | -2 | +2 | +1 | +5-3 | +7-1 | +1 | +5-3 | +3 |
对上述元素有关说法正确的是
A. 元素④的原子序数小于元素⑦的原子序数
B. ②、③处于同一周期
C. 上述八种元素中,最高价氧化物对应水化合物酸性最强的元素是⑤
D. ⑧号元素原子结构示意图为: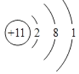
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应N2+3H2 ![]() 2NH3的能量变化下图所示,该反应的热化学方程式是
2NH3的能量变化下图所示,该反应的热化学方程式是
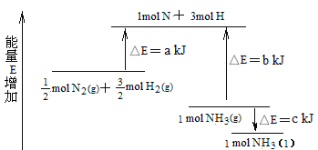
A.N2(g)+3H2(g) ![]() 2NH3(l) △H = 2(a-b+c) kJ/mol
2NH3(l) △H = 2(a-b+c) kJ/mol
B.N2(g)+3H2(g) ![]() 2NH3(l) △H = 2(a-b-c) kJ/mol
2NH3(l) △H = 2(a-b-c) kJ/mol
C.![]() N2(g)+
N2(g)+![]() H2(g)
H2(g) ![]() NH3(l) △H = (b+c-a) kJ/mol
NH3(l) △H = (b+c-a) kJ/mol
D.![]() N2(g)+
N2(g)+![]() H2(g)
H2(g) ![]() NH3(g) △H = (a+b) kJ/mol
NH3(g) △H = (a+b) kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是金属牺牲阳极的阴极保护法的实验装置,有关说法正确的是
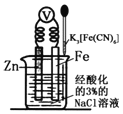
A. 若加入K3[Fe(CN)6]溶液后,Fe电极附近不会产生特征蓝色的沉淀
B. 本实验牺牲了金属Fe来保护金属Zn
C. 该装置为电解池
D. 远洋货轮上镶嵌的金属Zn长时间没有什么变化,不需要更换
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示。

据图判断正确的是
A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点酸的总浓度大于a点酸的总浓度
C.a点Kw的数值比c点Kw的数值大
D.b点溶液的导电性比c点溶液的导电性强
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是锂—空气电池的放电原理图(隔膜只允许锂离子通过)。电池放电时的反应可表示为:4Li+O2+2H2O=4LiOH。下列锂—空气电池放电时的有关说法正确的是( )

A. 正极反应式:Li-e-=Li+
B. 每转移2mol电子,消耗11.2L的O2
C. Li+不断向电池的正极移动
D. 可以去掉隔膜和有机电解液,让金属锂与水性电解液直接接触
查看答案和解析>>
科目: 来源: 题型:
【题目】在金属活动顺序表中,一般常用电解法冶炼的金属是
A. 钾、钠、铝等最活泼金属 B. 锌,铁等中等活泼性的金属
C. 常温下呈液态的金属 D. 金、铂等最贵重最不活泼的金属
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com