
科目: 来源: 题型:
【题目】有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。假如硅作为一种普遍使用的新型能源被开发利用,下列关于其有利因素的说法中,你认为不妥的是
A. 便于运输、储存,从安全角度考虑,硅是最佳的燃料
B. 自然界的含硅化合物易开采
C. 硅燃烧放出的热量大,燃烧产物对环境污染程度低且容易有效控制
D. 自然界中存在大量单质硅
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于碳和硅的叙述不正确的是( )
A. 最高价氧化物都能与氢氧化钠溶液反应 B. 单质在加热时都能与O2反应
C. 氧化物都能与水反应生成相应的酸 D. 在常温下,单质的化学性质都不活泼
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下图装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.25 mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是__________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是________。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)搅拌棒为何不用铜质的_____________.
(4)实验数据如下表:
①请填写下表中的空白:________。
温度 实验次数 | 起始温度 | 终止温度
| 温度差平均值 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55 mol·L-1NaOH溶液和0.25 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。依据上表数据计算中和热ΔH=________(取小数点后一位)。
③中和热测定实验中,下列操作一定会降低实验准确性的是______。
A.滴定管(精量仪器,读数保留到0.01)取所用酸碱溶液的体积
B.NaOH溶液在倒入小烧杯时,有少量溅出
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量硫酸溶液的温度计用水洗净后才用来测NaOH溶液的温度
查看答案和解析>>
科目: 来源: 题型:
【题目】关于如图所示装置的说法中,正确的是( )
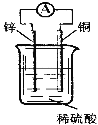
A. 铜片上发生氧化反应
B. 电子由铜片通过导线流向锌片
C. 该装置能将化学能转化为电能
D. 锌片是该装置的正极,该电极反应为Zn+2e—==Zn2+
查看答案和解析>>
科目: 来源: 题型:
【题目】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:

已知:3NO3-+ 8Al + 5OH- + 2H2O![]() 3NH3 + 8AlO2-
3NH3 + 8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是
试样中肯定存在NH4+、Mg2+、SO42-和NO3-
试样中一定不含Al3+
试样中可能存在Na+、Cl-
该雾霾中可能存在NaNO3 、NH4Cl和MgSO4
查看答案和解析>>
科目: 来源: 题型:
【题目】某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。
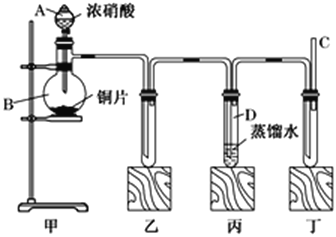
(1)装置甲中发生反应的化学方程式为________________________。
(2)装置丙中的试管内发生反应的离子方程式为:_______________________。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是________。
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为________色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加NH4SCN溶液,用离子方程式表示检验原理___________。
(5)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。
已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-889.6 kJ·mol-1①
N2(g)+2O2(g)===2NO2(g)ΔH=+67.7 kJ·mol-1②
则CH4还原NO2生成水蒸气和氮气的热化学方程式是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有一份含有FeCl3和FeCl2的固体混合物,为测定各成分的含量进行如下两个实验:
实验1:①称取一定质量的样品,将样品溶解;
②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀;
③将沉淀过滤、洗涤、干燥得到白色固体17.22 g。
实验2:①称取与实验1中相同质量的样品,将样品溶解;
②向溶解后的溶液中,通入足量的Cl2;
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀;
④将沉淀过滤、洗涤后,加热灼烧至质量不再减少,得到固体物质4 g。
根据实验回答下列问题:
(1)溶解过程中所用到的玻璃仪器有________________________。
(2)实验室配制FeCl2溶液时通常会向其中加入少量试剂________________。
(3)“实验2”通入足量Cl2的目的是_________。涉及的化学反应的离子方程式是__________。
(4)检验“实验2”的步骤④中沉淀已经洗涤干净的方法是________________。
(5)加热FeCl3溶液,并将溶液蒸干时,通常不能得到FeCl3固体,请以平衡的观点解释其原因(化学方程式与文字相结合来说明)____________________________________。
(6)FeCl3溶液可以用于止血,主要是因为FeCl3溶液能使血液聚沉,这涉及胶体的相关性质。以下关于胶体的说法正确的是________
A.胶体的分散质能透过滤纸
B.实验室制备胶体Fe(OH)3胶体,是将饱和FeCl3溶液滴入热的NaOH溶液中,加热至溶液变为红褐色
C.当光束通过胶体时能产生丁达尔效应
D.胶体、溶液、浊液中,含分散质粒子直径最大的分散系是胶体
(7)通过实验所得数据,计算固体样品中FeCl3和FeCl2的物质的量之比是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有X、Y、Z、T、U五种短周期元素。X、Y、Z三元素在周期表中的位置如图所示,三元素的原子序数之和是41。X和T的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)两种化合物。U单质在Z单质中燃烧时产生苍白色火焰,生成物的水溶液能使石蕊试液变红。
X | |
Y | Z |
(1)各元素的符号是X__________,Y__________,Z__________,T__________,U__________
(2)Y原子的结构示意图为__________
(3)用电子式表示Y与T组成的化合物的形成过程:__________
(4) YX2和U2Y反应的化学方程式为_______________________,其中氧化剂是__________,被氧化的元素是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】向2L密闭容器中通入amol气体A,在一定条件下发生反应:xA(g)![]() yB(g)+pC(g)+qD(g)。已知:平均反应速率
yB(g)+pC(g)+qD(g)。已知:平均反应速率![]() ;反应至2min时,A的物质的量减少为起始时的
;反应至2min时,A的物质的量减少为起始时的![]() ,生成B、D的物质的量分別为
,生成B、D的物质的量分別为![]() a mol、a mol。回答下列问题:
a mol、a mol。回答下列问题:
(1)0~2min内,![]() __________________。
__________________。
(2)该反应的化学方程式为_________________________________________。
(3)反应xA(g)![]() yB(g)+pC(g)+qD(g)达到化学平衡状态的标志是________(填序号)。
yB(g)+pC(g)+qD(g)达到化学平衡状态的标志是________(填序号)。
①A(g)的消耗速率与C(g)的生成速率之比为x:p
②A(g)的物质的量保持恒定
③A(g)的消耗速率与D(g)的消耗速率之比为q:x
④B(g)和C(g)的物质的量之比为y:p
(4)若A、B的起始浓度分别为m mol/L、n mol/L(C、D的起始浓度均为0),反应达到平衡时,A、B的浓度分别为0.5 mol/L、0.1 mol/L,则m、n应满足的关系为__________(用含m、n的等式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.如图A、B、C是实验室常见的几种气体发生装置:
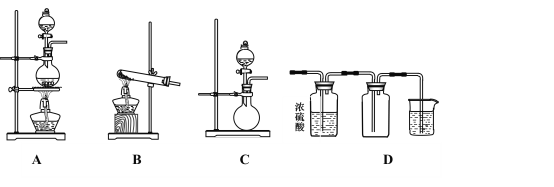
(1)实验室如果用B装置制备氨气,其化学方程式是_________________________________。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是_______(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(3)若用A装置与D装置相连制备并收集X气体,则X可以是下列气体中的___________。
①CO2 ②NO ③Cl2 ④H2
其中在D装置中连接小烧杯的目的是________________________________。
Ⅱ.海洋是一个巨大的资源宝库,从海水中可制得食盐等多种产品并加以利用。下图所示以食盐为原料进行生产并综合利用的某些过程。

(1)除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂
① Na2CO3 ② NaOH ③ BaCl2
沉淀剂加入顺序正确的是____________
A.③①② B.③②① C.②③① D.②①③
(2)将滤液的pH调至酸性除去的离子是____________________________________。
(3)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是____________。
(4)纯碱在生产、生活中有广泛的应用。
①由碳酸氢钠晶体制纯碱的化学方程式是____________________________________。
②纯碱可用于除灶台油污。其原因是(用离子方程式和简要文字表述)________________。
③工业上,可以用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是____________。(已知碳酸的酸性强于次氯酸)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com