
科目: 来源: 题型:
【题目】下列分子中的化学键既有极性键又有非极性键的是( )
A. CH3COONH4 B. Cl2 C. NH3 D. N2H4(分子中各原子均达到稳定结构)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某酸碱指示剂是一种有机弱酸,其在水溶液中的电离平衡与其呈现颜色相关:HIn(红色)H++In-(黄色),若向含此指示剂的溶液中加入盐酸,溶液将呈___色。
(2)下表列出了生产1 m3塑料的能耗和可从同量塑料回收的能量。
塑料 | 能耗/ kJ | 可回收能量/ kJ | 塑料 | 能耗/ kJ | 可回收能量/ kJ |
耐纶 | 7.8×104 | 4.2×104 | 丙烯酸类塑料 | 4.3×104 | 1.8×104 |
聚氯乙烯 | 3.8×104 | 1.6×104 | 聚丙烯 | 2.0×104 | 1.5×104 |
现废品收购站已回收如下数量的废塑料:耐纶5 m3、聚氯乙烯50 m3、丙烯酸类塑料5 m3、聚丙烯40 m3,如将它们加工成燃料,可回收能量______________ kJ。
(3)在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)zC(g);平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L。下列有关判断正确的(____)。
A.x+y<z B.平衡向正反应方向移动 C.B的转化率降低 D.C的体积分数增大
(4)2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3+Cl2PCl5.达平衡时,PCl5为0.40mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是(____)
A.0.40mol B.0.20mol C.小于0.20mol D.大于0.20mol,小于0.40mol
(5)为了研究土壤的酸碱性,某学生做了如下实验:将一定体积的蒸馏水加入一定质量的土壤中,充分搅拌后,过滤并留取滤液,测滤液的pH后向滤液中滴加氨水,每加入2mL氨水就搅拌均匀并测量溶液的pH,所得实验记录如下:
加氨水体积 | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
溶液的pH | 4 | 4 | 4 | 4 | 6 | 8 | 10 | 10 | 10 |
利用上述记录的数据,回答下列问题:
①所测土壤的酸碱性如何?_________(填酸性或者碱性)
②)所用氨水的c(OH—)为______________,
③为使该滤液呈中性,所加入氨水的恰当体积是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学反应或离子反应方程式正确的是
A. 苯与溴水反应:2![]() +Br2
+Br2![]()
B. 1一氯丙烷中加入氢氧化钠溶液并加热:CH3CH2CH2Cl+NaOH= CH3CH=CH2↑+NaCl+H2O
C. 苯酚钠溶液中通入少量CO2:C6H5O-+H2O+CO2→C6H5OH+HCO3-
D. 实验室制取乙炔的反应:CaC2+H2O → CaO + CH≡CH↑
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、X是中学化学中常见的物质。在一定条件下,它们之间的转化关系如下图所示(部分产物已略去)。
![]()
回答下列问题:
(1)若X是空气的主要成分之一,则A不可能是_____(填代号)。
a.Na b.C c.S d.Al
(2)若A常用作制冷剂,C为红棕色气体。写出由A生成B的化学方程式___________。
(3)若C可用于治疗胃酸过多,X是一种常见的温室气体。
①鉴别等浓度的B溶液和C溶液,可选用的试剂为______________(填化学式)。
②将A、B、C三种溶液混合,向45mL混合液中逐滴加入一定浓度的盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如下图所示。
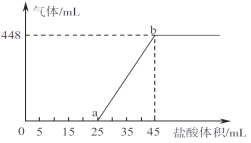
写出ab段所发生反应的离子方程式__________________________;b点对应溶液中溶质的物质的量浓度为___________(忽路溶液体积变化)。
查看答案和解析>>
科目: 来源: 题型:
【题目】C—C单键可以绕键轴旋转,其结构简式如下可表示为的烃,下列说法中正确的是
![]()
A. 该烃是苯的同系物B. 分子中最多有6个碳原子处于同一直线上
C. 该烃的一氯代物最多有四种D. 分子中至少有10个碳原子处于同一平面上
查看答案和解析>>
科目: 来源: 题型:
【题目】老鼠能在含饱和多氟碳化物的溶液内部获得氧气,像鱼儿一样在水中游动,另有实验表示,把狗身上的70%的血液,换成由25%的多氟碳化物和75%的水混合成的乳液后仍可存活,科学家预测多氟碳化物可能成为血液的替代品.全氟丙烷(C3F8)是一种常见的多氟碳化物,下列对该物质的叙述中正确的是
A. 全氟丙烷的电子式为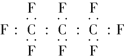 B. 原子半径C比F的小
B. 原子半径C比F的小
C. 全氟丙烷分子中的化学键只有共价键 D. 全氟丙烷分子中碳链成直线型
查看答案和解析>>
科目: 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述正确的是
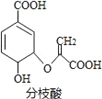
A. 分子中含有3种官能团
B. 分枝酸的分子式为C10H10O6
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目: 来源: 题型:
【题目】随原子序数的递增,七种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
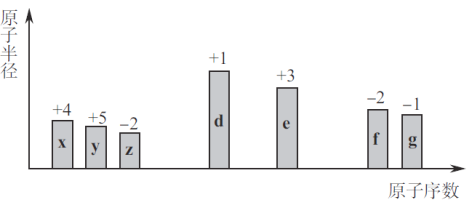
根据判断出的元素回答:
(1)x在元索周期表的位置是________________________。
(2)y的最高价氧化物对应的水化物与其氢化物反应,产物中含有化学键的类型为________________。
(3)d的单质在空气中充分燃烧,所得产物的电子式为________;7.8g该产物与足量的水完全反应,转移电子的数目为____________________。
(4)z、e、f的简单离子半径由大到小的顺序为_______________(用离子符号表示)。
(5)能说明g的非金属性比f强的实验事实是________________(列举一条)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com