
科目: 来源: 题型:
【题目】向Fe3O4发生的铝热反应后的生成物中,加入足量稀硫酸将其溶解,室温下向所得溶液中加入指定物质,反应后的溶液中主要存在的离子组正确的是
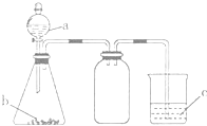
A. 通入过量Cl2:Cl-、Fe2+、SO42-、Al3+
B. 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH-
C. 加入过量氨水:OH-、NH4+、SO42-、AlO2-
D. 加入过量铜粉:Cu2+、Fe3+、SO42-、Al3+
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应2NO2(g) ![]() N2O4(g) △H<0。在密闭容器中进行,当达到平衡时,欲通过改变条件,达到新平衡后使气体颜色加深,应采取的措施是
N2O4(g) △H<0。在密闭容器中进行,当达到平衡时,欲通过改变条件,达到新平衡后使气体颜色加深,应采取的措施是
A. 增大容器体积
B. 温度压强不变,充入N2O4(g)
C. 温度体积不变,充入NO2(g)
D. 容器容积不变,降低温度
查看答案和解析>>
科目: 来源: 题型:
【题目】有关物质的转化关系如图所示(部分生成物和反应条件已略去)。D、F、G、H均为常见气体,其中D能使湿润的红色石蕊试纸变蓝,G呈黄绿色,H在空气中含量最高;C的摩尔质量为32g·mol-1;E为难溶性碱。
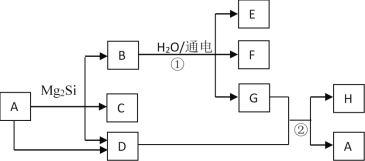
(1)C的化学式为_________;
(2)A的电子式为_________;
(3)写出反应①的离子方程式_______________;
(4)写出反应②的化学方程式________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】依据元素周期律,下列推断正确的是( )
A. 酸性:H2SiO3>H2CO3 B. 热稳定性:H2S>H2O
C. 碱性:KOH>Ca(OH)2 D. 若离子半径:R2﹣>M+,则原子序数:R>M
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4 +8H2O设计如下原电池,盐桥中装有饱和KCl溶液。下列说法正确的是

A. b电极上发生还原反应
B. 外电路电子的流向是从a到b
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. a电极上发生的反应为:MnO4-+8H++5e- = Mn2++4H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】原子序数依次增加的前四周期的主族元素A~H,有关性质如下:
元素代号 | A | B | C | D | E | F | G | H |
原子半径/nm | 0.037 | 0.074 | 0.073 | 0.071 | 0.143 | 0.102 | 0.099 | 0.114 |
主要化合价 | +1 | +5、-3 | -2 | -1 | +4、-4 | +6、-2 | +7、-1 | +7、-1 |
已知E的单质是一种常见的半导体材料,分析表中数据,用相应的化学式回答有关问题:
(1)元素A与C的原子个数比为1:1的化合物的电子式为_______。
(2)元素B、C、D的第一电离能由大到小的顺序为_______
(3)元素C、F形成的阴离子FC32-空间构型为_______
(4)元素G、H的气态氢化物的稳定性由强到弱顺序为________
(5)元素C、F的气态氢化物沸点由高到低的顺序为______,原因是______
(6)元素E的氢化物(EH4)属于_______分子(填“极性”或“非极性”)
(7)铬的基态原子价电子排布式为______。
(8)尿素[H2NCONH2]分子中,C原子的杂化方式为____;1mol尿素分子中,σ键的数目为______。
(9)带有六个结晶水三氯化铁,是橘黄色的晶体,其化学式为[Fe(H2O)6]Cl3,该化合物中,与Fe3+形成配位键的原子是______,写出H2O的一种阴离子的等电子体______
查看答案和解析>>
科目: 来源: 题型:
【题目】下列方程式书写正确的是
A.碳酸的电离方程式:H2CO3 ![]() 2H+ + CO32-
2H+ + CO32-
B. 硫化钠水解: S2-+2H2O![]() H2S +2OH-
H2S +2OH-
C.往AgI悬浊液中滴加Na2S饱和溶液:2Ag+ (aq)+ S2-(aq) = Ag2S(s)
D.用醋酸除水垢: 2CH3COOH + CaCO3 = 2CH3COO- + Ca2+ + H2O + CO2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C三种物质中均含有同一种元素,它们之间有如下图所示的转化关系(部分反应物质已略去)下列说法不正确的是
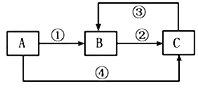
A. 若A是一种两性氧化物,则B的水溶液可呈酸性,C的水溶液可呈碱性
B. 若A是一种金属单质,则反应①②③均可为化合反应,反应④可为置换反应
C. 若A、B均是可燃性物质,完全燃烧都生成气体C,常温下A溶液PH<7,则将C通入A溶液中,pH先减小后增大
D. 若A、B、C是三种不同类别的固体物质,则B可以是工业上制取A、C的原料
查看答案和解析>>
科目: 来源: 题型:
【题目】《科学美国人》评出的2016年十大创新科技之一的碳呼吸电池,电池原理如下图所示,已知草酸铝[Al2(C2O4)3]难溶于水,则下列说法正确的是

A. 该装置将电能转变为化学能
B. 正极的电极反应为C2O42--2e- =2CO2
C. 每生成 1 mol Al2(C2O4)3,有 6 mol 电子流过负载
D. 随着反应的进行草酸盐浓度不断减小
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)在700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2 > t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2 > t1):
反应时间/min | 0 | t1 | t2 |
n(CO)/mol | 1.20 | 0.80 | 0.80 |
①反应在t1min内的平均速率:v(H2)=____mol·L-1·min-1。
②t2时刻,该反应的正反应速率___逆反应速率(填“大于”、“小于”或“等于”)。
(2)氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。
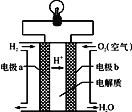
①该电池供电时,____能转化为____能。
②写出该电池供电时的总反应方程式________。
③电极b上发生______反应(“氧化”或“还原”)。
④在外电路中,电子流动的方向为________。
(3)镁铝合金(Mg17Al10)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al10+17H2=17MgH2+10Al。得到的混合物Y(17MgH2+10Al)在一定条件下可释放出氢气。
①镁铝合金的熔点比金属镁的熔点______。(填“高”或“低”)
②在6.0 mol·L-1 HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al10完全吸氢后得到的混合物Y与足量上述盐酸完全反应,释放出H2的物质的量为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com