
科目: 来源: 题型:
【题目】O3是一种常见的绿色氧化剂,可由臭氧发生器(原理如图)电解稀硫酸制得。下列说法错误的是
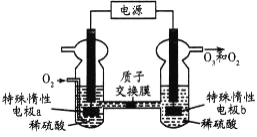
A. 电极a为阴极
B. a极的电极反应为O2+4H++4e-===2H2O
C. 电解一段时间后b极周围的pH下降
D. 标准状况下,当有5.6LO2反应时,收集到O2和O3混合气体4.48L,O3的体积分数为80%
查看答案和解析>>
科目: 来源: 题型:
【题目】N2O和CO是环境污染性气体,可在催化条件下转化为无害气体,反应进程中的能量变化如图所示。下列说法正确的是
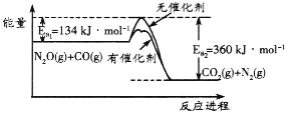
A. 加入催化剂使反应的△H变小
B. 该反应的热化学方程式为:N2O(g)+CO(g)===CO2(g)+N2(g) △H= - 226 kJ·mol-1
C. 反应物的总键能大于生成物的总键能
D. 该反应正反应的活化能大于逆反应的活化能
查看答案和解析>>
科目: 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2)为原料,生产Fe3O4的部分工艺流程如下:

下列说法错误的是
A. 用NaOH溶液吸收焙烧过程产生的SO2有利于保护环境和资源再利用
B. 从高硫铝土矿中可制得Al、Fe的化合物
C. 向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由AlO转化为Al3+
D. FeS2与Fe2O3混合后在无氧条件下焙烧的目的是生成Fe3O4和SO2
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA代表阿伏加德罗常数的值,下列说法正确的是
A. 0.5 mol锌粒与足量盐酸反应产生11.2 L H2 B. 0.1 mol CH4所含氢原子数为0.4NA
C. 标准状况下,11.2 L CCl4所含分子数为0.5NA D. 常温常压下,28 g N2中所含原子个数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】配制一定物质的量浓度的NaCl溶液时,导致浓度偏高的原因可能是
A. 移液时,不慎将液体流到瓶外 B. 容量瓶盛过NaCl溶液,使用前未洗涤
C. 容量瓶中原有少量的蒸馏水 D. 定容时读数仰视
查看答案和解析>>
科目: 来源: 题型:
【题目】关于胶体的叙述中,不正确的是
A. 向胶体中加蔗糖溶液,产生聚沉现象
B. 可见光透过胶体时,发生丁达尔现象
C. 用渗析的方法“净化”胶体时,使用的半透膜只能让小分子、离子通过
D. 胶体微粒能吸附阳离子或阴离子,故在电场作用下产生电泳现象
查看答案和解析>>
科目: 来源: 题型:
【题目】根据化学能和热能、电能相关的知识,请回答下列问题:
I.已知31 g白磷(P4)变为31 g红磷(P)时释放能量。上述变化属于_____变化;稳定性白磷_____红磷(填“>”或“<”);
II.氢气是一种清洁能源,在我国航天工程中也有应用。
(1)已知:2H2+O2![]() 2H2O。该反应1g氢气完全燃烧放出热量121kJ,其中断裂1molH—H键吸收436kJ,断裂1molO=O键吸收496kJ,那么形成1molH—O键放出热量_______________。
2H2O。该反应1g氢气完全燃烧放出热量121kJ,其中断裂1molH—H键吸收436kJ,断裂1molO=O键吸收496kJ,那么形成1molH—O键放出热量_______________。
(2)航天技术上使用的氢-氧燃料电池原理可以简单看作下图“氢-氧燃料电池的装置图” 则:
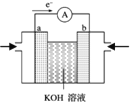
①a极为电池的______(填“正极”或“负极”);溶液中OH-移向_______电极(填“a”或“b”)。
②b电极附近pH_______。(填增大、减小或不变)。
③如把H2改为甲烷,则电极反应式为:负极_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】毒品冰毒属于芳香族化合物,分子中只含有碳、氢、氮三种元素,相对分子质量不超过150,碳元素和氢元素质量分数之和为90.6%。请按要求填空:
(1)冰毒的摩尔质量为___________,分子式为___________。
(2)冰毒的同分异构体有很多,写出同时符合下列三项要求的冰毒的同分异构体的结构简式。(只要求写出其中的三种)。①苯环上只含有两个相邻的取代基②分子中含有氨基(—NH2)③分子中含有两个甲基(—CH3)____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,已知0.1mol/L的NaX、NaY、NaZ溶液,其pH值分别8、9、10,则HX、HY、HZ的酸性强弱排列正确的是( )
A.HX>HY>HZB.HY>HX>HZ
C.HZ>HY>HXD.HZ>HX>HY
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com