
科目: 来源: 题型:
【题目】室温下,将0.1mol/L的一元酸HA溶液逐滴滴加到10mL0.1mol/LNaOH溶液中,pH的变化曲线如图所示。下列说法错误的是
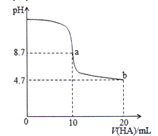
A. a点所示溶液中c(Na+)>c(A-)>c(OH-)>c(HA)
B. a、b两点所示溶液中水的电离程度a点大于b点
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. 一元酸HA为弱酸
查看答案和解析>>
科目: 来源: 题型:
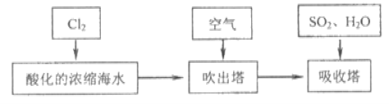
【题目】海水约占地球表面积的71%,具有十分巨大的开发潜力。下图是开水资源综合利用的工艺图,以下说法正确( )

A. 电解NaCl溶液时可用铁做电极,其离子方程式为:2Cl- + 2H2O = 2OH-+ H2↑+ Cl2↑
B. 向苦卤中加入Cl2的作用是置换出溴单质,该过程体现了还原性:Cl- > Br-
C. 实验室模拟海水提取淡水,除夹持装置外只用到的仪器有蒸馏烧瓶、酒精灯、锥形瓶
D. Br2 与SO2的水溶液发生反应的离子方程式为:Br2 + SO2 + 2H2O =4H+ + 2Br- + SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】某锂-空气电池放电时的工作原理如图所示。下列叙述正确的是( )
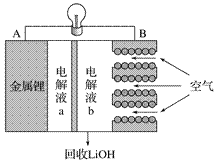
A. 放电时电子由B极经导线向A极移动
B. 电池放电时B电极的反应式为O2 +2H2O + 4e-===4OH -
C. 电解液a、b之间可采用阴离子交换膜
D. 当A电极消耗14g金属锂时,B电极有标况下22.4L氧气参与反应
查看答案和解析>>
科目: 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
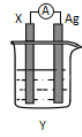
(1)电极X的上发生的电极反应为______反应(氧化或还原);电解质溶液Y是________;
(2)银电极为电池的_____极,发生的电极反应式为_______;
(3)外电路中的电子__________(填“流出”或“流向”)Ag电极。
(4)当有1.6 g铜溶解时,银棒增重______ g。
(5)现有如下两个反应:(A))NaOH+HCl=NaCl+H2O (B)2FeCl3+Fe=3FeCl2
①根据两反应本质,分别判断能否用于设计原电池,如果不能,说明其原因_______________。
②如果可以,写出正极反应式:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今社会面临的严峻课题,回答下列问题:
(1)我国是世界上少数以煤为主要燃料的国家,下列关于煤作燃料的论点正确的是 ___________________(填字母)。
A.煤是重要的化工原料,把煤作燃料简单燃烧掉太可惜,应该综合利用
B.煤是发热量很高的固体燃料,我国煤炭资源相对集中,开采成本低,用煤作燃料实惠
C.煤燃烧时产生大量二氧化硫和烟尘,对环境污染严重
D.通过洁净煤技术,如煤的气化和液化,以及烟气脱硫,不仅减轻了燃煤污染,还能提高煤燃烧的热利用率
(2)乙醇是未来内燃机的首选环保型液体燃料。2.0 g乙醇完全燃烧生成液态水放出59.43 kJ的热量,则乙醇燃烧的热化学方程式为____________________________________________________________。
(3)由于C3H8(g)=C3H6(g)+H2(g) ΔH=+b kJmol1(b>0)的反应中,反应物具有的总能量________(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要________(填“放出”或“吸收”)能量才能转化为生成物。
(4)关于用水制取二次能源氢气,以下研究方向不正确的是________________
A.组成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二次能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊催化剂,用于开发廉价能源,以分解水制取氢气
(5)已知下列两个热化学方程式:
A、2H2(g)+O2(g) ===2H2O(l) △H=-571.6 kJmol-1 B、C3H8(g)+5O2(g) ===3CO2(g)+4 H2O(l) △H=-2 220 kJmol-1,其中,能表示燃烧热的热化学方程式为___________(A或B),其燃烧热为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
A. 单位时间内消耗1molA的同时生成2molC
B. 单位时间内消耗nmolA的同时生成2nmolB
C. A、B、C的物质的量之比为1:2:3
D. A、B、C的浓度不再发生变化
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是资源的宝库:合理利用海水资源是当今是世界研究的重点课题。结合所学知识回答下列问题:
(1)列举一项海水中的能源:__________ ,海水中储量最大的资源是________ ,获得该资源最古老的方法是____________。
(2)海水中还有大量NaCl,MgCl2等盐类物质,从海水中获得纯净NaCl的分离提纯方法有过滤、______。
(3)目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
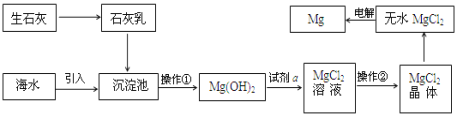
提示: MgCl2晶体的化学式为MgCl26H2O; MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
①操作②的名称___________、冷却结晶、过滤。
②用氯化镁电解生产金属镁的化学方程式为:_____________________。
(4)粗盐提纯后的的卤水中含有大量的溴,从中提取溴的部分过程如下:
实验室模拟上述过程设计以下装置进行实验(所有橡胶制品已被保护,夹持装置已略去)
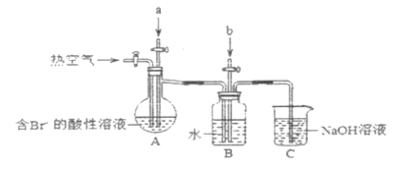
①A装置中通入a气体的目的是(用离子方程式表示) __________________________________________;
②A装置中先通入a气体后改通热空气。通入热空气的目的是______________________________________;
③B装置中b气体是SO2,目的是吸收富集Br2,此处离子方程式为___________________________________;
④向B装置中再次通入Cl2得到单质溴,对液体进行蒸馏,收集液溴。蒸馏应该选择下列仪器_____(填序号) 。
 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应4A(g)+ 5B(g)== 4C(g)+ 6D(g)在10L的密闭容器中进行,半分钟后,D的物质的量增加了0.45mol,则此反应的平均速率v(x)可表示为( )
A. v(A)=0.0010mol·L-1·s-1
B. v(B)=0.0010mol·L-1·s-1
C. v(C)=0.010mol·L-1·s-1
D. v(D)=0.045mol·L-1·s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】分子式为C2H4O2的有机化合物A具有如下性质:
①A+Na → 迅速产生气泡;
②A+CH3CH2OH ![]() 有香味的物质。
有香味的物质。
(1)根据上述信息,对该化合物可做出的判断是_________(填字母)。
A.一定含有—OH B.一定含有—COOH
C.有机化合物A为乙醇 D.有机化合物A为乙酸
(2)A与金属钠反应的化学方程式为_____________
(3)化合物A和CH3CH2OH反应生成的有香味的物质的结构简式为_______________。
(4)有机化合物B的分子式为C2H4O3,与Na反应迅速产生H2,且1 mol B与足量Na反应放出1 mol H2,则B的结构简式为________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某仅由碳、氢、氧三种元素组成的有机化合物,经测定其相对分子质量为90。取有机物样品1.8 g,在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重1.08 g和2.64 g。试求该有机物的分子式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com