
科目: 来源: 题型:
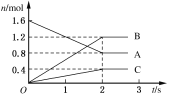
【题目】(1)某温度下,在体积为5 L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为__________,2 s内用A的浓度变化和用B的浓度变化表示的平均反应速率分别为________、________。
(2)把0.6 mol X气体与0.6 mol Y气体混合于2 L容器中发生反应:2X(g)+Y(g)=nZ(g)+2W(g),2 min末已生成0.2 mol W,若测得以v(Z)浓度变化表示的v(Z)=0.1 mol/(L·min)。求:
(1)n=_____?
(2)前2 min内,v(X)=_____?
(3)2 min末时Y的浓度_____?
查看答案和解析>>
科目: 来源: 题型:
【题目】I.把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用下图所示的坐标曲线来表示。

请回答下列问题。
(1)曲线由O→a段不产生氢气的原因是____________________。
有关反应的化学方程式为_________________________。
(2)曲线由a→c段,产生氢气的速率增加较快的主要原因是_______________________________。
(3)曲线由c以后产生氢气的速率逐渐下降的主要原因是_______________________________。
II.某同学在用稀硫酸与锌反应制取氢气的实验中,发现加入少量硫酸铜溶液可以加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有:______________、_________________;
(2) 硫酸铜溶液可以加快氢气生成速率的原因:__________________;
(3) 实验中现有Na2SO4、MgSO4、 Ag2SO4、 K2SO4四种溶液,可与上述实验中CuSO4溶液起相似作用的是:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验制取氨气的化学方程式_______________________________;
(2)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的?________(填“能”或“否”)。理由是______________________。
(二)该小组中某同学设计了下图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性:
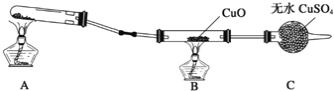
(1)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是:_______________________________________________________________________。
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式___________________。
(三)问题讨论:
有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性差(Cu+→Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O:______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学-—选修3:物质结构与性质]东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_____。
③氨的沸点(填“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。
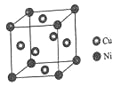
①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm。
查看答案和解析>>
科目: 来源: 题型:
【题目】以下是依据一定的分类标准,对某些物质与水反应情况进行分类的图示。
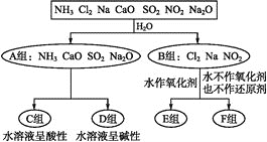
请根据你所学的知识,按要求填空:
(1)上述第一级分类标准(分成A,B组的依据)是____。
(2)F组中物质除了Cl2外还有____(填化学式)。
(3)A组中的CaO经常用作食品包装袋中的干燥剂,CaO所属的物质类型为____(用序号填空)。
①金属氧化物 ②碱性氧化物 ③碱 ④碱性干燥剂
CaO可作干燥剂的理由是____________(用化学方程式表示)。
(4)D组中NH3的水溶液呈弱碱性,用电离方程式表示其呈弱碱性的原因:________。
(5)由Al3+制备Al(OH)3,最好不选择D组中的NaOH溶液,说明理由:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知酸性高锰酸钾溶液可以将FeSO4氧化,化学方程式为2KMnO4+10FeSO4+8H2SO4===K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示。则下列有关说法不正确的是( )
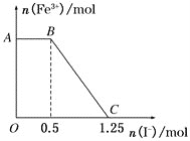
A. 图中AB段主要是高锰酸钾和碘化钾溶液反应
B. 图中BC段发生的反应为2Fe3++2I-===2Fe2++I2
C. 根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol
D. 根据OC段的数据可知开始加入的硫酸亚铁的物质的量为1 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如下图所示。则下列说法正确的是( )

A. X与A反应的化学方程式是:Al2O3 + 2Fe ![]() Fe2O3 + 2Al
Fe2O3 + 2Al
B. 检验D溶液中的金属阳离子的反应:Fe3++3SCN—= Fe(SCN)3↓
C. 单质Y在一定条件下能与水发生置换反应
D. 由于化合物B和C均既能与酸反应,又能与碱反应,所以均是两性化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】下列生活中常见物质的俗名与化学式相对应的是
A.苏打—NaHCO3B.明矾—KAlSO4·12H2O
C.碳铵—(NH4)2CO3D.胆矾—CuSO4·5H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】在如图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,其中P为电解质溶液。由此判断M、N、P所代表的物质可能是( )
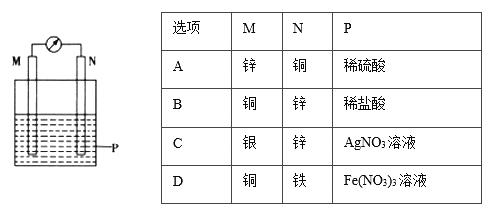
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式,正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为 CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com