
科目: 来源: 题型:
【题目】如表为元素周期表的一部分.
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为______________________。
(2)表中元素原子半径最大的是(写元素符号)_____________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是___________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁生成的1mol化合物Q与水反应生成2mol Mg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为_________。Q与水反应的化学方程式为____。
(5)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50,为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2molL-1NaOH溶液和1mol O2,则两种气体的分子式及物质的量分别为____________。生成硫酸铜物质的量为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】丙烯(CH2=CH—CH3)是一种重要的基本化工原料。结合以下合成路线,回答下列问题。
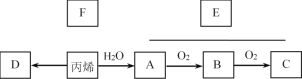
(1)丙烯中所含官能团的名称是_____。
(2)工业上常利用丙烯和氯化氢的反应来制备F,该反应的反应类型是_____。
(3)以丙烯为原料合成有机高分子化合物D。丙烯→D的化学方程式是_____。
(4)已知:2CH3CHO+O2![]() 2CH3COOH以丙烯为原料可以合成一种有香味的物质E。实验室可通过图所示装置来实现。
2CH3COOH以丙烯为原料可以合成一种有香味的物质E。实验室可通过图所示装置来实现。
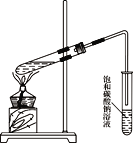
① A→B的化学方程式是:_____。
② A+C→E的化学方程式是:_____。
③若要把制得的E分离出来,应采用的实验操作是_____(填操作名称)。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式下列判断正确的是( )
(i) I2(g)+H2(g)![]() 2HI(g)△H=﹣9.48kJ/mol
2HI(g)△H=﹣9.48kJ/mol
(ii) I2(S)+H2(g)![]() 2HI(g)△H=+26.48kJ.
2HI(g)△H=+26.48kJ.
A. 1 mol I2(g)中通入2gH2(g),反应放热9.48 kJ
B. 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C. 反应(i)的产物比反应(ii)的产物稳定
D. 反应(ii)的反应物总能量比反应(i)的反应物总能量低
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素A、B、C、D、E和F的原子序数依次增大。元素A与元素C可形成A2C、A2C2两种化合物;元素C与元素D可形成D2C、D2C2两种化合物;元素B形成的化合物种类繁多且元素B与元素E处于同一主族;元素C与元素F处于同一主族。
(1)写出C的元素符号__________,D形成简单离子的结构示意图___________;
(2)写出元素A一种原子的中子数是质子数2倍的核素的符号____________;
(3)元素E在周期表中位置___________;
(4)比较E和F最高价氧化物对应水化物的酸性强弱______________(用化学式表示)
(5)写出A2C2电子式___________________;D与A形成化合物电子式_________________;元素A与B形成化合物A2B2的结构式________________;
(6)元素B与氮元素形成的化合物的晶体具有高熔点且耐磨等特点,推测该晶体是_________晶体。
(7)写出C与D以原子个数比1∶1形成的化合物与水反应的化学方程式:_________________;若生成0.5 mol氧化产物,则转移的电子数目为__________(用NA表示);
(8)取8.3g仅由D和氮元素形成的某化合物与足量水充分反应后产生0.1mol氨气,写出该化合物与过量盐酸反应的化学方程式_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目: 来源: 题型:
【题目】利用人工模拟光合作用合成甲酸的原理为:2CO2+2H2O![]() 2HCOOH+O2,装置如图所示,下列说法不正确的是( )
2HCOOH+O2,装置如图所示,下列说法不正确的是( )
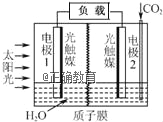
A. 电子由电极1经过负载流向电极2
B. 若将质子膜换成阴离子交换膜,该电池依然能够正常工作
C. 电极2的反应式:CO2+2H++2e﹣=HCOOH
D. 该装置能将太阳能转化为化学能和电能
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关原电池的叙述中不正确的是 ( )
A.原电池是将化学能转化为电能的装置
B.构成原电池的两个电极必须是活泼性不同的两种金属
C.锌、铜、硫酸组成的原电池中,溶液中的 Zn2+、 H+均向正极移动
D.在原电池中,电子流出的一极是负极,发生氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的.周期数与主族序数相等。
![]()
请回答下列问题:
(1)W在周期表中的位置是____________________________________,Q、R、T三种元素原子半径由大到小的顺序为____________________________________________________________________。(用元素符号表示),QO2的电子式为________________________,R的最高价氧化物的化学式____________________________。
(2)T单质与NaOH 溶液反应的离子方程式为____________________________________________________________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用铋酸钠(NaBiNO3)检验溶液中的Mn2+,反应方程式为:4MnSO4+10NaBiO3+14H2SO4═4NaMnO4+5Bi2(SO4)3+3Na2SO4+口,下列说法不正确的是
A. 口内的物质为水,配平系数为14。
B. 若生成1mol NaMnO4,则转移5mole-
C. 反应方程式中的硫酸可换为盐酸
D. 溶液中有Mn2+的现象是溶液变为紫红色
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液A中可能只含有Fe3+、Fe2+、Ag+、Mg2+、Al3+、NH4+、Cl-、NO3—、SO42—中的若干种离子,为确认其中含有的各离子,取1 L溶液A,进行如下所示实验:

已知:气体A、气体B的体积都为2.24 L(标准状况下),沉淀B的物质的量为0.1 mol。根据以上实验操作与现象,判断下列说法错误的是( )
A. 溶液A中一定含有Fe2+、NH4+、Ag+、NO3—,一定不含Cl-、SO42—
B. 沉淀A中一定含有Fe(OH)3,可能含有Mg(OH)2 、Al(OH)3
C. 溶液D中可能含有Al3+
D. 溶液A中的c(NO3—)≥1.0 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com