
科目: 来源: 题型:
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,其处理流程图如下:
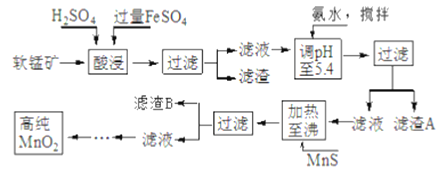
化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-35 | 10-6 | 10-38 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为______________________。
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能___________;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH 至少达到____________,恰好能使Fe3+、A13+沉淀完全。(当离子浓度降到1.0×10-5mol·L-1时即视为沉淀完全)
(3)滤渣B的成分是___________________。
(4)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极电极反应式为_____________________________________________________。
(5)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.9200g该样品,与足量酸性KI 溶液充分反应后,配制成100mL溶液。取其中20.00mL,恰好与25.00mL 0.0800mol·L-1Na2S2O3溶液反应(I2+2S2O32-=2I-+S4O62-)。计算可得该样品纯度_____%。(小数点后保留1位数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将 0.10 mol·L-1 盐酸滴入 20.00 mL 0.10 mol·L-1 氨水中,溶液中 pH 和 pOH 随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列正确的是

A. M 点所示溶液中可能存在c(Cl-)> c(NH4+)
B. N 点所示溶液中可能存在:c (NH4+)+ c(NH3﹒H2O)= c(Cl-)
C. Q 点盐酸与氨水恰好中和
D. M 点到Q点所示溶液中水的电离程度先变大后减小
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是 ( )
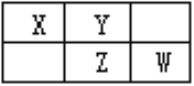
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 四种元素的单质中,W单质的熔沸点最高
D. W的单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目: 来源: 题型:
【题目】根据有关信息完成下列各题:
(1)有机物A是有机物B(![]() )的同分异构体,核磁共振氢谱测得其分子中只有两种不同化学环境的氢,且数目比为1:3,写出其中三种的结构简式:____、____、____。
)的同分异构体,核磁共振氢谱测得其分子中只有两种不同化学环境的氢,且数目比为1:3,写出其中三种的结构简式:____、____、____。
(2)有机物B在一定条件下反应生成有机物C,1mol有机物C最多可以和2molBr2发生加成反应,写出有机物B在一定条件下反应生成有机物C的化学方程式:____。
(3)已知:![]() 。
。
写出用![]() 为原料(其他无机试剂任选)制备高分子
为原料(其他无机试剂任选)制备高分子 的合成路线____。合成反应流程图表示方法例如:
的合成路线____。合成反应流程图表示方法例如:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于能量转换的认识中错误的是
A.电解水时,电能转化为化学能
B.电动车行进时,电能主要转化为化学能
C.煤燃烧时,化学能主要转化为热能
D.水力发电时,机械能转化为电能
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在25℃、101kPa时,1gCH4完全燃烧生成液态水时放出的热量是55.64 kJ,则表示甲烷燃烧热的热化学方程式是___________________________________________。
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)===3CO2(g)+4H2O(l)
ΔH=-2 220.0 kJ· mol-1,已知CO气体燃烧的热化学方程式为2CO(g)+O2(g)===2CO2(g) ΔH=-565.14 kJ·mol-1,试计算相同物质的量的C3H8和CO燃烧产生的热量的比值________(保留小数点后一位)。
(3)氢气既能与氮气发生反应又能与氧气发生反应,但是反应的条件却不相同。
已知:2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ· mol-1
3H2(g)+N2(g)![]() 2NH3(g) ΔH=-92.4 kJ· mol-1
2NH3(g) ΔH=-92.4 kJ· mol-1

计算断裂1 mol N≡N键需要消耗能量________kJ。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据有关信息完成下列各题:
(1)有机物A是人工合成的香料。其结构简式为: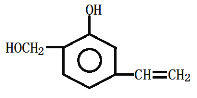 。该化合物中含有的官能团名称是____。在一定条件下,1mol有机物A消耗H2和Br2的物质的量之比为:____。写出有机物A在催化剂作用下发生加聚反应的化学方程式:____。
。该化合物中含有的官能团名称是____。在一定条件下,1mol有机物A消耗H2和Br2的物质的量之比为:____。写出有机物A在催化剂作用下发生加聚反应的化学方程式:____。
(2)①用系统命名法命名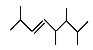 :____。②用习惯命名法命名
:____。②用习惯命名法命名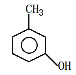 为:____。
为:____。
(3)实验室中通常加热无水乙醇与浓硫酸的混合物的方法制取乙烯,浓硫酸的作用是乙醇反应的催化剂和吸水剂。在具体的化学实验中常因加热的温度过低或过高导致副反应发生。如图所表示的装置可以用于确认乙烯气体中是否混有副反应生成的SO2。
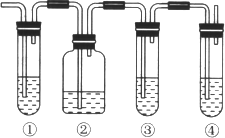
可选择的化学试剂有:A.品红溶液 B.烧碱溶液 C.浓硫酸 D.酸性高锰酸钾溶液
回答下列问题:
(I)图中③的试管内盛放的化学试剂是____(填序号),其作用是____。
(II)根据④中消耗溶液的物质的量计算反应生成乙烯的物质的量,发现其数值远远小于理论生成的乙烯的物质的量,分析可能的原因是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】原子序数依次增大且小于36的X、Y、Z、Q、W四种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的3倍,Z与Y同族,Q原子基态时3p原子轨道上有1个未成对的电子,W的原子序数为29。回答下列问题:
(1)X2Y2分子中Y原子轨道的杂化类型为____。
(2)化合物沸点比较:X2Y____X2Z,其原因是____。
(3)元素Z最高价氧化物对应水化物的阴离子空间构型为____,与该离子互为等电子体且含有Q元素的一种分子的分子式是____。
(4)W基态原子的核外电子排布式是____,元素W的一种氯化物晶体的晶胞结构如下图所示,该氯化物的化学式是____。

查看答案和解析>>
科目: 来源: 题型:
【题目】下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务
[实验目的]制取乙酸乙酯
[实验原理]甲、乙、丙三位同学均采取乙醇、乙酸与浓H2SO4混合共热的方法制取乙酸乙酯,反应的方程式为______________________________________该反应类型______________其中浓H2SO4的作用是_________________和_________________
[装置设计]甲、乙、丙三位同学分别设计下列三套实验装置
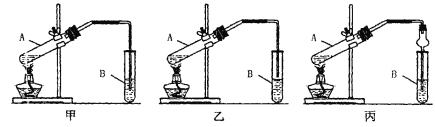
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,我选择的装置是__________(选填“甲”或“乙”),丙同学将甲装置中的玻璃管改成球形干燥管,除起冷凝作用外,另一重要作用是_____________
[实验步骤]①按我选择的装置仪器,在试管中先加入3mL乙醇,并在摇动下缓缓加入2mL浓H2SO4 充分摇匀,冷却后再加入2mL冰醋酸;②将试管固定在铁架台上;③在试管B中加入适量的饱和Na2CO3溶液;④用酒精灯对试管A加热;⑤当观察到试管B中有明显现象时停止实验。
[问题讨论]
(1)步骤①装好实验装置,加入样品前还应检查_________________
(2)试管B中饱和Na2CO3溶液的作用是_________________________
(3)从试管B中分离出乙酸乙酯的实验操作是__________________
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化还原反应在生产、生活中具有广泛的用途。下列生产、生活中的事例不包含氧化还原反应的是( )
A.金属的冶炼B.燃料的燃烧
C.卤水点豆腐D.绿色植物的光合作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com