
科目: 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
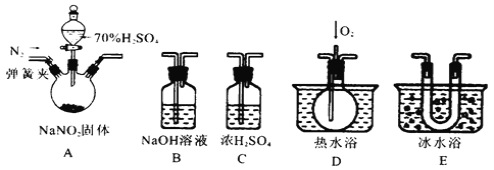
已知:①NO+NO2+2OH-=2NO2-+H2O
②气体液化的温度:NO2(21℃)、NO(–152℃)
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→_____________;组装好仪器后,接下来进行的操作是________________。
(2)关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后,A中产生红棕色气体。
①确认A中产生气体含有NO,依据的现象是_____________________________。
②装置E的作用是_______________________________________________________。
(3)如果没有装置C,对实验结论造成的影响是______________________________。
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】H2S2O3是一种弱酸,实验室欲用0.01 mol/L的Na2S2O3溶液滴定碘水,发生的反应为I2+2Na2S2O3===2NaI+Na2S4O6,下列说法正确的是( )
A. 该滴定反应可用甲基橙作指示剂
B. Na2S2O3是该反应的还原剂
C. 该滴定反应可选用如下图所示的装置
D. 该反应中每消耗2 mol Na2S2O3,转移电子的物质的量为4 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子在相应的条件下可能大量共存的是( )
A. 能使pH试纸变红的溶液中:CO32—、K+、Cl-、Na+
B. 由水电离产生的c(OH-)=1×10-10mol·L-1的溶液中:NO3—、Mg2+、Na+、SO42—
C. 在![]() =1×1012的溶液中:NH4+、Fe2+、Cl-、NO3—
=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3—
D. ![]() =10-14mol·L-1的溶液中:Na+、HCO3—、Cl-、K+
=10-14mol·L-1的溶液中:Na+、HCO3—、Cl-、K+
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、M、W五种短周期元素。X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示。下列说法错误的是( )

A. 原子半径:W>Y>Z>M>X
B. 酸性:HYO3>H2WO3
C. 仅由X、Y、Z三种元素形成的化合物中不可能含离子键
D. WM4分子中每个原子最外层均满足8电子结构
查看答案和解析>>
科目: 来源: 题型:
【题目】在以下各种情形下,下列电离方程式的书写正确的是
A.熔融状态下的NaHSO4电离:NaHSO4=Na++H++SO42-
B.H2CO3的电离:H2CO3![]() 2H++CO32-
2H++CO32-
C.Fe(OH)3的电离:Fe(OH)3![]() Fe3++3OH-
Fe3++3OH-
D.水溶液中的NaHSO4电离:NaHSO4=Na++HSO4-
查看答案和解析>>
科目: 来源: 题型:
【题目】对于放热反应Zn+H2SO4===ZnSO4+H2↑,下列叙述正确的是( )

A. 反应过程中的能量关系可用上图表示
B. 1 mol Zn的能量大于1 mol H2的能量
C. 若将其设计为原电池,则锌作正极
D. 若将其设计为原电池,当有32.5 g Zn溶解时,正极放出的气体一定为11.2 L
查看答案和解析>>
科目: 来源: 题型:
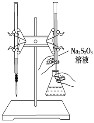
【题目】某化学兴趣小组测定某Fe2(SO4)3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
①称取a g样品,置于烧杯中;
②加入50 mL 1.0 mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.0 mL溶液;
③量取25.0 mL步骤②中配得的溶液,置于烧杯中,加入适量氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑥……
请根据上面叙述,回答:

(1)上图所示仪器中,步骤①②③中必须用到的仪器有E和___________(填字母)。
(2)步骤②中:配制50 mL 1.0 mol/L稀H2SO4,需要用量筒量取98%(密度1.84 g/cm3)的浓H2SO4体积为________ mL。
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
____Fe2++ ClO2+ === Fe3++ Cl-+ H2O
从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果的影响是__________(填“偏大”“偏小”或“不影响”),等物质的量ClO2与Cl2的氧化效率之比为__________。
(4)若步骤⑤不在干燥器中冷却,则测定的铁元素的质量分数会________(填“偏大”“偏小”或“不影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是元素周期表的一部分,参照元素①﹣⑧在表中的位置,请用化学用语回答下列问题:

(1)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是(填化学式)____________________.
(2)在①、④、⑤、⑧中的某些元素之间可形成既含离子键又含非极性共价键的离子化合物,写出其中一种化合物的电子式: ______________________
(3)由②和④组成的化合物与⑤的同周期相邻主族元素的单质反应的化学方程式为:______________
(4)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为________________.
(5)常温下,由①②④组成最简单的液态有机物可作为燃料电池的原料之一,请写出其在碱性介质中的电极反应式:_________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】将CO2气体缓缓地通入到含KOH、Ba(OH)2和K[Al(OH)4]的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示。下列关于整个反应进程中的各种描述不正确的是

A. o—a段反应的化学方程式是:Ba(OH)2 + CO2 = BaCO3↓+ H2O
B. b—c段反应的离子方程式是:2[Al(OH)4]-+ CO2 = 2Al(OH)3↓ +CO32-+ H2O
C. a—b段与c—d段所发生的反应相同
D. d—e段沉淀的减少是由于碳酸钡固体的消失所致
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com