
科目: 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2- 等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2 + CO ![]() CO2 + NO 该反应的平衡常数为K1(下同)
CO2 + NO 该反应的平衡常数为K1(下同)
每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________________以及此热化学方程式的平衡常数K=____________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的![]() ,则反应开始到平衡时CO的平均反应速率v(CO)=________。
,则反应开始到平衡时CO的平均反应速率v(CO)=________。
若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围________________。
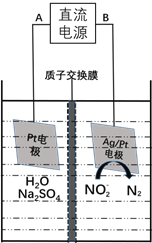
(3)电化学降解NO2-的原理如下图:
①电源的负极是____________(填A或B)阴极反应式为________________。
②若电解过程中转移了6mol电子,则膜两侧电解液的质量变化差![]() 为_____g。
为_____g。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化硫是重要的化工原料,用途非常广泛。
(1)实验室用如图所示装置B制取连二亚硫酸钠(Na2S2O4)。

①实验中要控制生成SO2的速率,可采取的措施有(至少写一条)_________
②B装置中用甲醇作溶剂,C中NaOH的作用是__________。
(2)二氧化硫能够抑制细菌的滋生,可用作防腐剂,但必须严格按照国家标准使用。实验室用已知浓度的碘水来测定某粉丝样品中二氧化硫的残留量,装置如图所示。

①将粉丝样品粉碎,准确称取5.0 g,放入三颈烧瓶中,加入稀硫酸浸泡30分钟,再加适量蒸馏水,加热1小时(加热装置略去),使二氧化硫完全进入吸收装置。
②往吸收装置中加入3滴淀粉溶液作指示剂,再逐滴加入0.001 mol·L-1 I2标准溶液。
当溶液颜色__________时,恰好完全反应,写出反应的离子方程式________;恰好反应时消耗I2标准溶液10.00 mL,测得样品中SO2的残留量为________ g·kg-1。
③在配制I2标准溶液,定容加水时仰视刻度线,则测得SO2含量_______(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.某反应在体积为5L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如下图所示(已知A、B、C均为气体)。
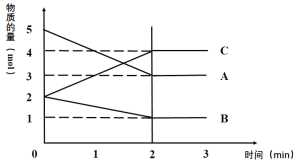
(1)该反应的化学方程式为__________________。
(2)反应开始至2分钟时,B的平均反应速率为______________。
(3)能说明该反应已达到平衡状态的是_________。
A.υ(A)=2υ(B) B.容器内气体密度不变 C.υ逆(A)=υ正(C)
D.各组分的物质的量相等 E. 混合气体的平均相对分子质量不再改变的状态
(4)由图求得平衡时A的转化率为________。
II.已知甲烷燃烧的化学反应方程式为CH4+2O2![]() CO2+2H2O,若以4mol/L 500mL KOH(aq)为电解质溶液,将其设计为原电池,则
CO2+2H2O,若以4mol/L 500mL KOH(aq)为电解质溶液,将其设计为原电池,则
(1)其正极电极方程式为___________。
(2)至某时刻溶液中c(CO32-)=1mol/L,则导线上通过的电子的物质的量为_____,此时消耗标准状况下CH4体积_____ L 。(假设化学能全部转化为电能;溶液体积保持不变)
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是某工业生产过程。

溶解度表:
温度℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
氯化铵 | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 55.2 | 65.6 | 71.3 | 77.3 |
硫酸铵 | 70.6 | 73 | 75.4 | 78 | 81 | 88 | 95 | 98 | 103 |
硫酸钾 | 7.4 | 9.3 | 11.1 | 13 | 14.8 | 18.2 | 21.4 | 22.9 | 24.1 |
氯化钾 | 28 | 31.2 | 34.2 | 37.2 | 40.1 | 45.8 | 51.3 | 53.9 | 56.3 |
(1)本工业生产过程的目标产品是____________________________________。(写化学式)
(2)过滤Ⅰ操作所得固体中,除CaCO3外还有一种物质,该固体的用途有_________(试举一例)。
(3)根据溶解度表转化Ⅱ适宜的温度是________
A、0~10℃ B、20~30℃ C、40~60℃ D、90~100℃
过滤Ⅱ操作所得滤渣是__________。
(4)我国著名的化学家也利用了转化Ⅱ的反应原理制备了一种重要的碱,该制备的化学反应方程式为:___________________________________________________
(5)氯化钙结晶水合物(CaCl2·6H2O)进行脱水处理可制得常用的干燥剂,根据下图选择最佳脱水的方法是__________

A、氯化氢气流中加热到174℃ B、直接加热至174℃
C、直接加热至260℃ D、氯化氢气流中加热到260℃
(6)上述工业流程实现了绿色化学的理念,其中__________________(填化学式)实现了循环利用,副产品_________________________(填化学式)可转化为原料,整个流程基本实现了污染物零排放。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:
①H2(g)+![]() O2(g)
O2(g) ![]() H2O(g);ΔH1= a kJ·mol-1
H2O(g);ΔH1= a kJ·mol-1
②2H2(g)+O2(g) ![]() 2H2O(g);ΔH2= b kJ·mol-1
2H2O(g);ΔH2= b kJ·mol-1
③H2(g)+![]() O2(g)
O2(g)![]() H2O(l);ΔH3= c kJ·mol-1
H2O(l);ΔH3= c kJ·mol-1
④2H2(g)+O2(g)![]() 2H2O(l);ΔH4= d kJ·mol-1
2H2O(l);ΔH4= d kJ·mol-1
下列关系正确的是( )
A. c<a <0 B. b>a > 0 C. 2a=d <0 D. 2c=d >0
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在一固定容积的密闭容器中进行如下反应N2+3H2![]() 2NH3,下列情况一定能说明反应已达到平衡的是
2NH3,下列情况一定能说明反应已达到平衡的是
①容器内压强不随时间而变化
②单位时间内,有3molH2反应,同时有2molNH3生成
③气体的密度不随时间而变化
④单位时间内,有1molN2生成,同时有2molNH3生成
⑤用N2、H2、NH3表示的该反应的化学反应速率之比为1∶3∶2
⑥气体的平均摩尔质量不随时间而变化
A.①④⑥ B.①②③ C. ②③⑤ D.①②⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】研究物质性质的基本程序是一个系统化的过程,其主干可分为四个步骤.下列是研究物质性质的一般程序的第一步是
A. 预测物质性质 B. 观察物质的外观性质
C. 进行实验和观察 D. 做出有关的解释和结论
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为H2与O2反应生成H2O(g)的能量变化示意图,下列有关叙述不正确的是

A. 1 mol H2分子断键需要吸收436 kJ的能量
B. H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/mol
C. 反应物的总能量高于生成物的总能量
D. 形成化学键释放的总能量比断裂化学键吸收的总能量小
查看答案和解析>>
科目: 来源: 题型:
【题目】1 mol/L H2SO4的含义是
A.1L 水中含有1mol H2SO4 B.1L 溶液中含有1mol H+
C.1L H2SO4溶液中含98g H2SO4 D.将98g H2SO4溶于1L水配成溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com