
科目: 来源: 题型:
【题目】下列有关物质的性质与用途正确且具有对应关系的是
A.SO2具有氧化性,可用于漂白纸浆
B.NH4HCO3受热易分解,可用作氮肥
C.金属钠具有还原性,可从硫酸铜溶液中置换出铜
D.Al2O3熔点高,可用作耐高温材料
查看答案和解析>>
科目: 来源: 题型:
【题目】硫化氢毒性很大,俗称“一口闷”,工业废水中的硫化物在酸性条件下会以硫化氢的形式逸出。某课外小组以碘量法测定废水中的硫化物,实验装置如图所示,实验步骤及测定原理如下:

Ⅰ.取样、吹气、固硫
连接装置,打开氮气源,检查装置气密性。移取一定体积1mol·L-1乙酸锌溶液于两支吸收管中,取200mL水样于反应瓶中,通入氮气一段时间。移取10mL盐酸于反应瓶中,水浴加热,继续通入氮气。已知乙酸锌与硫化氢反应生成硫化锌沉淀(硫化氢被完全吸收)。
Ⅱ.滴定
关闭气源,往两个吸收管中各加入0.010mol·L-1的碘标准溶液100mL(过量),再加入盐酸5mL,静置。加入淀粉指示液,用0.010mol·L-1的硫代硫酸钠标准溶液对两支吸收管中的液体进行滴定。
(已知:![]() )
)
回答下列问题:
(1)反应瓶中前后通入氮气的目的分别是________________、_________________。
(2)加入碘标准溶液时,吸收管中发生反应的化学方程式为________________。
(3)该实验使用两个吸收管的原因是____,若只使用一个吸收管,会导致测定结果偏____(填“高”或“低”)。
(4)实验室常用FeS固体与酸常温下反应制取H2S。实验室制取H2S时,从反应物与生成物的状态、性质和反应条件分析,下列发生装置中可选用的是_______________(填序号)。
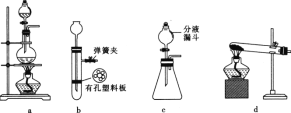
(5)上图a中盛装液体药品的玻璃仪器名称为________。
(6)将二氧化氯溶液加入硫化氢溶液中,然后加入少量稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成。写出二氧化氯与硫化氢溶液反应的离子方程式:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对于有机物![]() 的叙述正确的是
的叙述正确的是
A. 在一定条件下1mol该物质最多与4molH2发生加成反应
B. 该物质不能与碳酸氢钠反应放出二氧化碳
C. lmol该物质与足量的金属钠反应生成2molH2
D. 该物质含羟基与苯环直接相连的结构且能水解的同分异构体有19种
查看答案和解析>>
科目: 来源: 题型:
【题目】常温时,改变饱和氯水的pH,得到部分含氯微粒的物质的量分数与pH的关系如图所示。下列叙述不正确的是
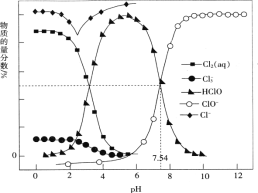
A. 氯水中的Cl2、ClO-、HClO均能与KI发生反应
B. 常温下反应Cl2(aq)+Cl-(aq)![]()
![]() (aq)的K=0.191,当pH增大时,K减小
(aq)的K=0.191,当pH增大时,K减小
C. pH=1的氯水中,c(Cl2)>c(![]() )>c(HClO)>c(ClO-)
)>c(HClO)>c(ClO-)
D. 该温度下,HClO![]() H++ClO-的电离常数Ka的对值lgKa=-7.54
H++ClO-的电离常数Ka的对值lgKa=-7.54
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 丙烯分子中所有原子均在同一平面上
B. ![]() 命名为2-甲基-3-丁炔
命名为2-甲基-3-丁炔
C. 化合物![]() 不是苯的同系物
不是苯的同系物
D. C5H12的同分异构体数目与甲苯的一氯代物数目相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下表列出了①~⑥六种元素在周期表中的位置:
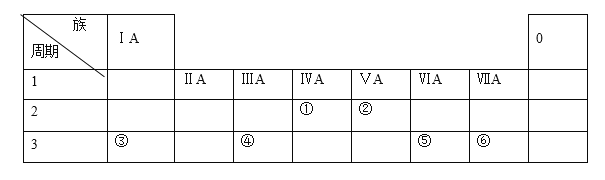
请按要求回答下列问题。
(1)元素①的元素符号是________。 元素②的单质电子式是_______。元素⑤的原子结构示意图是_______。
(2)③和⑥形成的化合物中所含化学键类型_______。
(3)HF沸点比⑥氢化物的沸点_____(高或低),原因是________。
(4)这六种元素中,位于第三周期且原子半径最小的是(填元素符号)________。
(5)这六种元素的最高价氧化物中,属于两性氧化物的元素是(填元素符号)___________。
(6)在盛有水的小烧杯中加入元素③的单质,发生反应的离子方程式为_________________。向上述反应后的溶液中再加入元素④的单质,发生反应的化学方程式为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数。X与Y位于不同周期,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8,元素Z的单质是目前使用量最大的主族金属元素单质。下列说法中正确的是
A. 离子化合物YX4W溶于水后,得到的溶液呈碱性
B. 化合物YW3为共价化合物,电子式为![]()
C. Y、Z形成的一种化合物强度高,热膨胀系数小,是良好的耐热冲击材料
D. 工业上常用电解Z与W形成的化合物的方法制取单质Z
查看答案和解析>>
科目: 来源: 题型:
【题目】在含Fe3+的![]() 和I-的混合溶液中,反应
和I-的混合溶液中,反应![]() 的分解机理及反应进程中的能量变化如下:
的分解机理及反应进程中的能量变化如下:
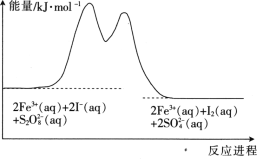
步骤①:2Fe3+(aq)+2I-(aq)=I2(aq)+2Fe2+(aq)
步骤②:![]()
下列有关该反应的说法正确的是
A. 反应速率与Fe3+浓度有关
B. 该反应为吸热反应
C. v(![]() )=v(I-)=v(I2)
)=v(I-)=v(I2)
D. 若不加Fe3+,则正反应的活化能比逆反应的大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com