
科目: 来源: 题型:
【题目】镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
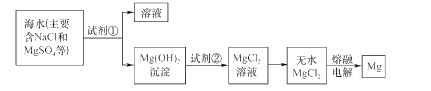
(1)为了使MgS04转化为Mg(OH)2,试剂①可以选用____(填化学式)。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是____。
(3)试剂②可以选用 ___(填化学式)。
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为:_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子在溶液中既可以大量共存,且加入氨水后也不产生沉淀的是( )
A.Na+、Ba2 +、Cl-、SO42-B.K+、AlO2-、NO3-、OH-
C.H+、NH4+、Al3+、SO42-D.H+、Cl-、CH3COO-、NO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】无水FeCl3呈棕红色,极易潮解, 100 ℃ 左右时升华,工业上常用作有机合成催化剂。实验室可用下列装置(夹持仪器略去)制备并收集无水FeCl3。
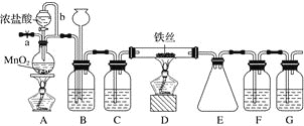
(1)装置A中反应的离子方程式为____________________________________________。
(2)装置F中所加的试剂为________。
(3)导管b的作用为________________________________________________________;
装置B的作用为__________________________________________________________。
(4)实验时应先点燃A处的酒精灯,反应一会儿后,再点燃D处的酒精灯,原因为__________。
(5)反应结束后,拆卸装置前,必须进行的操作是______________________。
(6)为检验所得产品为FeCl3,可进行如下实验:取E中收集的产物少许,加水溶解,向所得溶液中加入
________________________(填试剂名称和现象)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取A 9.0 ,升温使其汽化,测其密度是相同条件下氢气的45倍。 | (1)A的相对分子质量为:___________。 |
(2)将此9.0 gA在足量纯氧气中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g。 | (2)A的分子式为:_______________________。 |
(3)另取A 9.0 g,跟足量的碳酸氢钠粉末反应,生成2.24 LCO2(标准状况),若与足量金属钠反应则生成2.24 L氢气(标准状况)。 | (3)写出A中含有的官能团:____、_____。 |
(4)A的核磁共振氢谱如下图:
| (4)A中含有______种氢原子。 |
(5)综上所述A的结构简式_______________________。 | |
查看答案和解析>>
科目: 来源: 题型:
【题目】在pH=12的无色溶液中能大量共存的离子组是( )
A.NH4+、Mg2+、SO42-、Cl-B.Ba2+、K+、OH-、 NO3-
C.Al3+、Cu2+、SO42-、Cl-D.Na+、Ca2+、Cl-、AlO2-
查看答案和解析>>
科目: 来源: 题型:
【题目】第五主族的磷单质及其化合物在工业上有广泛应用.
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)═3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)═6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)═P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)═CaSiO3(s)△H3
用△H1、△H2和△H3表示△H,则△H=______;
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子产物,其结构式为______,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为______;

(3)次磷酸钠(NaH2PO2)可用于工业上的化学镀镍.
①化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性等条件下发生下述反应:
(a) Ni2++ H2PO2﹣+ → Ni++ H2PO3﹣+
(b)6H2PO﹣2+2H+═2P+4H2PO3+3H2↑
请在答题卡上写出并配平反应式(a) ___________________________;
②利用①中反应可在塑料镀件表面沉积镍﹣磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀.请从以下方面比较化学镀与电镀.
方法上的不同点:______;
原理上的不同点:______;
化学镀的优点:______.
查看答案和解析>>
科目: 来源: 题型:
【题目】某含氧有机化合物可以作为无铅汽油的抗爆震剂,其相对分子质量为88.0,含C的质量分数为0.682,含H的质量分数为0.136。
(1)试确定该化合物的分子式___。
(2)经红外光谱和核磁共振氢谱显示该分子中有4个甲基。请写出其结构简式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】因发生氧化还原反应在水溶液中不能大量共存的离子组是( )
A.Ca2+、Br - 、Fe3+ 、CO32-B.Fe2+、Cl-、NO3- 、H+
C.Fe3+ 、Ca2+、 H+ 、NO3-D.NO3-、OH- 、Cl-、Ba2+
查看答案和解析>>
科目: 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:

回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为____________________________,基态S原子电子占据最高能级的电子云轮廓图为________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________________。

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为anm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为______________________________g·cm-3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为________nm。
所形成的正八面体的体心,该正八面体的边长为________nm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com