
科目: 来源: 题型:
【题目】A是一种酯,分子式是C14H12O2,A可以由醇B跟羧酸C发生酯化反应得到,A不能使溴的CCl4溶液褪色,氧化B可以得到C。
(1)写出A、B、C的结构简式:A、______,B、________,C、____________。
(2)写出B的两种同分异构体的结构简式,它们都可以跟NaOH反应________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业生产需要大量原料,消耗大量能源,在得到所需产品同时产生了大量废气、废水、废渣。某工厂排放的废水中含有Cu2+、Fe2+、Hg2+、H+等离子,某化学小组为了充分利用资源和保护环境,准备回收废水中的铜和汞,同时得到绿矾。他们设计了如下实验方案:
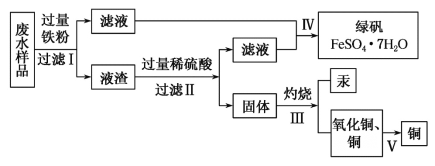
(1)现有仪器:酒精灯、玻璃棒、坩埚、蒸发皿、蒸馏烧瓶、烧杯、铁架台等,完成步骤Ⅳ的实验操作还需要选择的玻璃仪器是__________设计简单实验检验绿矾是否变质,简述你的操作:__________。
(2)步骤Ⅰ中加入过量铁粉的目的是__________,步骤Ⅱ中__________(填“能”或“不能”)用盐酸代替硫酸。
(3)步骤V利用氧化铜制取铜有如下四种方案:
方案甲:利用氢气还原氧化铜;
方案乙:利用一氧化碳还原氧化铜;
方案丙:利用炭粉还原氧化铜;
方案丁:先将氧化铜溶于稀硫酸,然后加入过量的铁粉、过滤,再将滤渣溶于过量的稀硫酸,再过滤、洗涤、烘干。
从安全角度考虑,方案__________不好;从产品纯度考虑,方案__________不好。
(4)写出步骤Ⅱ中涉及反应的离子方程式:__________;步骤Ⅳ得到绿矾的操作蒸发浓缩__________、__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】NO、NO2等氮氧化物的消除和再利用有多种方法。
(1)活性炭还原法:某研究小组向某密闭容器中加入足量的活性炭和NO,发生反应:C(s)+2NO(g) N2(g)+ CO2(g) △H = Q kJ·mol-1,在T℃下,反应进行到不同时间测得各物质的浓度部分数据如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.40 | 0.20 | 0.30 | 0.30 | |
N2 | 0 | 0.40 | 0.60 | 0.60 | ||
CO2 | 0 | 0.60 | 0.60 |
①0~10min内,N2的平均反应速率v(N2)= ___________ .
②30min后,若只改变一个条件,反应重新达到平衡时各物质的浓度如上表所示,则改变的条件可能是 ____ (填序号).
a.加入一定量的活性炭 b.改变反应体系的温度
c.缩小容器的体积 d.通入一定量的NO e.使用催化剂
(2)NH3催化还原法:原理如图所示。
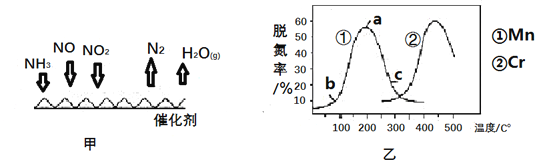
①若烟气中c(NO2) :c(NO)=1 :1,发生图甲所示的脱氮反应时,每转移1.5mol电子放出的热量为113.8kJ,则发生该脱氮反应的热化学方程式为__________________.
②图乙是在一定时间内,使用不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应温度分别为_____________;使用Mn作催化剂时,脱氮率b-a 段呈现如图变化的可能原因是__________(答1点).
(3)直接电解吸收法:先用6%的稀硝酸吸收NOx,生成HNO2(弱酸),再将吸收液导入电解槽中进行电解,使之转化为硝酸,则阳极的电极反应式为________________.
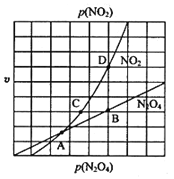
(4)NO2与N2O4之间存在转化:N2O4(g) 2NO2(g),将一定量的N2O4放入恒容密闭容器中。
①己知N2O4的起始压强p0为108 kPa,325℃时,N2O4的平衡转化率为40%,则该温度下反应的平衡常数为:Kp=________kPa(用平衡分压代替平衡浓度计算,分压=总压×各物质的量分数,保留一位小数).
②在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率-压强关系如图所示,在图标出的点中,能表示反应达到平衡状态的点为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.我国的青海省有许多盐湖盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用。粗盐中含Ca2+、Mg2+、SO42-以及泥沙等杂质,为了除去可溶性杂质,有以下实验步骤进行提纯:
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。
(1)以下操作顺序不合理的是 _______。
A.②⑤④③① B.④⑤②①③ C.⑤②④①③ D.⑤④②①③
(2)用提纯的NaCl配制450 mL 4.00 mol·L-1NaCl溶液,所用仪器除天平、药匙、烧杯、玻璃棒外还有________(填仪器名称)。
(3)通过步骤①中过滤后的滤液,检验SO42-是否除尽的操作方法是_________________________
Ⅱ.向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。回答下列问题:
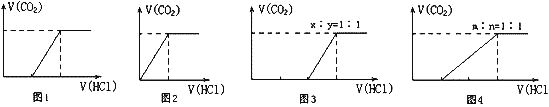
(1)图1中通入CO2后所得溶液的溶质成分为____________________;
(2)图3中通入CO2后所得溶液的溶质成分为____________________。
Ⅲ.已知氮化镁极易与水反应:Mg3N2+6H2O===2NH3↑+3Mg(OH)2↓。将足量的镁条置于空气燃烧,可能会发生下列反应①2Mg+O2![]() 2MgO;②3Mg+N2
2MgO;②3Mg+N2![]() Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2![]() 2MgO+C;④Mg+H2O(g)
2MgO+C;④Mg+H2O(g)![]() MgO+H2。请设计一个实验,验证产物中含有氮化镁(Mg3N2):_________________________。
MgO+H2。请设计一个实验,验证产物中含有氮化镁(Mg3N2):_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④B.⑤⑥⑦⑧C.③⑤⑥⑦⑧D.③④⑤⑥⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点-105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(S)、液氯和三氧化硫为原料在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量比为______________.
(2)甲同学设计如图装置用ZnCl2 xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并利用装置F验证生成物中的某种气体(夹持及加热装置略)。
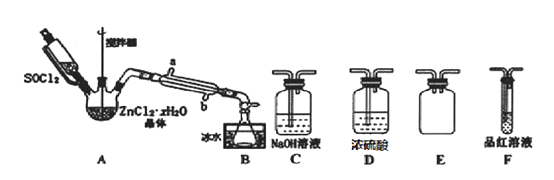
①用原理解释SOCl2在该实验中的作用______________________________________;加热条件下,A装置中总的化学方程式为____________________.
②装置的连接顺序为A→B→_____________________;
③实验结束后,为检测ZnCl2 xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为_____________(填序号)
a.加入足量硝酸酸化的硝酸银溶液,充分反应; b.称得固体为n克; c.干燥;d.称取蒸干后的固体m克溶于水;e.过滤;f.洗涤
若m/n=______________(保留小数点后一位),即可证明晶体已完全脱水.
(3)乙同学认为SOCl2还可用作由FeCl3 6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式______________________.
②丙同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3 6H2O于试管中,加入足量SOCl2,振荡使两种物质充分反应;
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
(供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、BaCl2溶液、K3[Fe(CN)6]溶液、溴水)
方案 | 操作 | 现象 | 结论 |
方案一 | 往一支试管中滴加_____________ | 若有白色沉淀生成 | 则发生了上述副反应 |
方案二 | 往另一支试管中滴加 _____________ | __________________ | 则没有发生上述副反应 |
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物有如下转化关系:
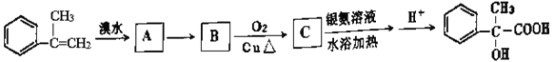
(1)写出反应A→B的反应条件是____________,C中官能团的结构简式是______________。
(2)反应B→C的反应类型为____________。
(3)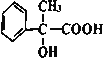 在浓硫酸加热条件可以生成含有三个六元环结构的有机物,该有机物结构简式为:____________。
在浓硫酸加热条件可以生成含有三个六元环结构的有机物,该有机物结构简式为:____________。
(4)任意写出一种符合下列条件的C的同分异构体的结构简式______________
①属于芳香族化合物,苯环上有两个取代基
②与碳酸氢钠溶液反应放出二氧化碳气体
③苯环上的一氯代物有两种
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物的结构简式如图所示,关于该物质的叙述错误的是( )

A.一个分子中含有12个H原子
B.苯环上的一氯代物有2种
C.能使酸性KMnO4溶液褪色
D.1mol该物质分别与足量H2、NaOH溶液反应,消耗其物质的量均为3mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A.液氨用作制冷剂发生的是化学反应
B.氨气溶水得到氨水发生的只是物理变化
C.分离液态空气制取氮气属于氮的固定
D.氮气与氢气化合生成氨气属于人工固氮
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验方案合理的是( )
A. 配制银氨溶液:向洁净试管中加一定量AgNO3溶液后,边滴加稀氨水边摇动试管直至最初产生的沉淀恰好溶解。
B. 配制Cu(OH)2悬浊液:在一定量CuSO4溶液中,加入少量NaOH溶液
C. 制备乙酸乙酯:用右图所示的实验装置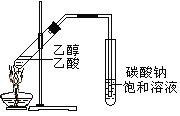
D. 鉴别甲苯和苯:将溴的四氯化碳溶液分别滴加到少量甲苯和苯中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com