
科目: 来源: 题型:
【题目】华法林(Warfarin)又名杀鼠灵,被美国食品药品监督管理局批准为心血管疾病的临床药物。其合成路线(部分反应条件略去)如下所示:
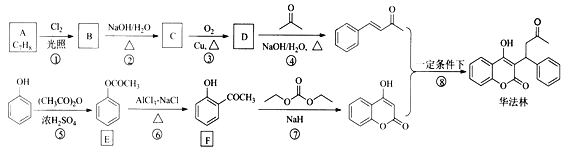
回答下列问题:
(1)A的名称为_______,E中官能团名称为________。
(2)B的结构简式为________。
(3)由C生成D的化学方程式为_________
(4)⑤的反应类型为______,⑧的反应类型为_________。
(5)F的同分异构体中,同时符合下列条件的同分异构体共有__________种。
a.能与FeCl3溶液发生显色反应 b.能发生银镜反应
其中核磁共振氢谱为五组峰的结构简式为_________。
(6)参照上述合成路线,设计一条由苯酚(![]() )、乙酸酐(CH3CO)2O和苯甲醛(
)、乙酸酐(CH3CO)2O和苯甲醛(![]() )为原料,制备
)为原料,制备 的合成路线(其他无机试剂任选)_____。
的合成路线(其他无机试剂任选)_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:

(1)M电极的材料是________,其电极反应式为:________N的电极名称是________,电极反应式为:________
(2)通入甲烷的铂电极的电极反应式为________.
(3)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为________ L(标准状况下)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu:相对原子质量为64)。
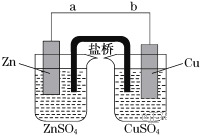
按照实验步骤依次回答下列问题:
(1)导线中电流方向为__________________(用a、b表示)。
(2)原电池的正极为___________
(3)写出装置中铜电极上的电极反应式:____________________________________;
(4)若装置中铜电极的质量增加32 g,则导线中转移的电子数目为________;
(5)装置的盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,盐桥中的K+向______(填“左侧”或“右侧”)烧杯移动
查看答案和解析>>
科目: 来源: 题型:
【题目】磷的单质和化合物在科研与生产中有许多重要用途,铜及其合金是人类最早使用的金属材料。请回答下列问题:
(1)白磷是磷的一种单质,其分子结构如图所示,则一个分子中有____对成键电子对和____对孤电子对。

(2)N和P都有+5价,PCl5能形成离子型晶体,晶格中含有[PCl4]+和[PCl6]-,则[PCl4]+空间构型为______。
(3)电负性比较:P_____S(填“>”“=”“<”);而P的第一电离能比S大的原因是______。
(4)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4。
①铜元素在周期表中的位置是__________ ,1mol[Cu(NH3)4]SO4 有___mol配位键 ;②[Cu(NH3)4]SO4中,存在的化学键的类型有_____(填标号)。
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
(5)磷化镓(GaP)材料是研制微电子器件、光电子器件的新型半导体材料。GaP的晶体结构是闪锌矿型结构(如图所示),晶胞参数apm。
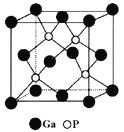
①与Ga紧邻的P个数为________。
②GaP晶体的密度为(列出计算式) ______g·cm-3(NA为阿伏加德罗常数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在蒸馏实验中,下列说法不正确的是( )
A. 温度计的水银球应放在蒸馏烧瓶的支管口处
B. 冷凝管中冷却水的流向是从上向下流
C. 加入沸石的作用是防止液体暴沸
D. 可以不用温度计
查看答案和解析>>
科目: 来源: 题型:
【题目】下图![]() 为直流电源,
为直流电源,![]() 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,![]() 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现![]() 上的c点显红色,为实现铁上镀锌,接通
上的c点显红色,为实现铁上镀锌,接通![]() 后,使c、d两点短路.下列叙述正确的是
后,使c、d两点短路.下列叙述正确的是

A. a为直流电源的负极
B. c极发生的反应为2H++2e-=H2↑
C. f电极为锌板
D. e极发生还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)已知反应NO2(g)+CO(g) = NO(g) +CO2(g)的能量变化如上图所示,下列说法正确的是________。
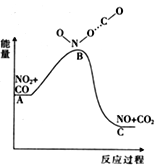
A.图中A→B的过程为放热过程
B.1molNO2和1molCO的键能总和大于1molNO和1molCO2的键能总和
C.该反应为氧化还原反应
D.1molNO2(g)和1molCO(g)的总能量低于1molNO(g)和1molCO2(g)的总能量
(2)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度的变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度的变化如图所示。
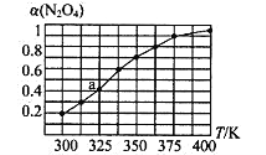
①由图推测该反应的△H___0(填“>”或“<”),理由为________________。
②图中a点对应温度下,已知N2O4的起始压强为108 kPa,则该温度下反应的平衡常数Kp=_________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
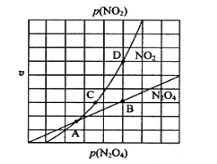
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系υ( N2O4)=k1p(N2O4),υ(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=___________,在下图上标出的点中,能表示反应达到平衡状态的点为__________(填字母代号)。
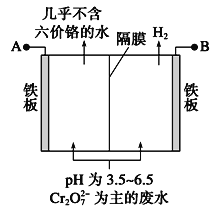
(3)采用电解法处理含铬废水原理如下图所示。阳极的电极反应式为___________,阳极区溶液中发生反应: ________________________,阴极产生的气体为_______(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com