
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 实验室用大理石和稀盐酸制取CO2:2H++CO![]() ===CO2↑+H2O
===CO2↑+H2O
B. 碳酸氢钠与烧碱溶液反应:H++CO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
C. 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO![]() ===BaSO4↓
===BaSO4↓
D. 醋酸跟KOH溶液反应:CH3COOH+OH-===CH3COO-+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】关于反应2KI+O3+H2O ==2KOH+I2+O2,下列说法正确的是
A.当有2 molKI被氧化时,2 mol氧原子被还原
B.O2是还原产物
C.若消耗2.24 L O3,则转移0.2 mol电子
D.氧化剂与还原产物的物质的量之比为1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】(10分)、反应A(g)+B(g)![]() C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。

(1)该反应是____________________反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率______(填“增大”“减小”“不变”),原因是_______________________________;
(3)反应体系中加入催化剂对反应热是否有影响?________,原因是_________:
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”“减小、”“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
(1)用C 表示10s内反应的平均反应速率为____________。
(2)反应前A的物质的量浓度是_______________。
(3)10s末,生成物D的浓度为______________________。
(4)A 平衡转化率______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是
A. 氯气溶于水:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 钠与水反应:Na+2H2O===Na+2OH+H2↑
C. 氧化亚铁溶于稀硝酸:FeO+2H+===Fe2++H2 O
D. 向碳酸氢铵溶液中加入足量石灰水:NH4++HCO3-+Ca2++2OH-===CaCO3 ↓+NH3·H2O+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】如图示与对应的叙述符合的是
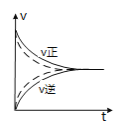
A. 如图可知实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
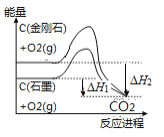
B. 如图可知,反应C(金刚石,s) ══ C(石墨,s)的焓变ΔH ══ ΔH1-ΔH2
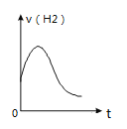
C. 如图可知表示除去氧化膜的镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应
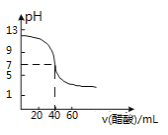
D. 如图可知表示25℃时用0.1000 mol·L-1醋酸滴定40.00 mL 0.1000 mol·L-1NaOH溶液得到的滴定曲线
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是石蜡油在炽热碎瓷片的作用下产生乙烯,并检验乙烯性质的实验。
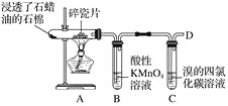
回答下列问题:
(1)从装置A中出来的气体中含有烷烃和________。
(2)B中酸性高锰酸钾溶液________,这是因为生成的气体被________(填“氧化”或“还原”),反应类型为________。
(3)C中溴的四氯化碳溶液________,发生反应的化学方程式:____________,反应类型为________。
(4)在D处点燃之前必须进行的操作是__________,燃烧时反应的化学方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不能够用勒夏特勒原理来解释的是
A. 实验室用排饱和食盐水的方法收集氯气
B. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后(AgBr是淡黄色沉淀),溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后(AgBr是淡黄色沉淀),溶液颜色变浅
C. SO2催化氧化制SO3的过程中使用过量的氧气,以提高二氧化硫的转化率
D. 恒温、恒压条件下,在2NO2![]() N2O4平衡体系中充入He后,体系颜色变浅
N2O4平衡体系中充入He后,体系颜色变浅
查看答案和解析>>
科目: 来源: 题型:
【题目】对恒温恒容密闭容器中的可逆反应:A(g)+3B(g)![]() 2C(g) H <0,下列错误的是( )
2C(g) H <0,下列错误的是( )
A. 升高温度,v(正)、v(逆)都增大,但v(逆)增加的程度更大
B. 增大压强,v(正)、v(逆)都增大,但v(正)增加的程度更大
C. 增大A的浓度,v(正)会增大,但v(逆)会减小
D. 使用催化剂,一般v(正)、v(逆)同时增大,而且增大的倍数相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com