
科目: 来源: 题型:
【题目】(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为0.20mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成________沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度为________。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
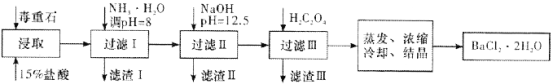
①毒重石用盐酸浸取前需充分研磨,目的是________。
②加入NH3·H2O调节pH=8可除去________(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是________。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL 0.01mol·L-1 Na2SO4溶液,下列叙述正确的是___(填字母)。
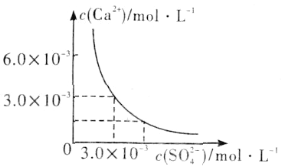
A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
查看答案和解析>>
科目: 来源: 题型:
【题目】对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应如下:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4下列关于该反应的说法正确的是( )
A. CuSO4发生了氧化反应 B. 生成1 mol H3PO4时,有10 mol 电子转移
C. 白磷只作还原剂 D. 氧化产物和还原产物的物质的量之比为6∶5
查看答案和解析>>
科目: 来源: 题型:
【题目】一定物质的量的Cl2与NaOH溶液反应,所得产物中含NaClO和NaClO3物质的量之比为3∶5,则参加反应的Cl2与NaOH物质的量之比为( )
A. 8∶11 B. 3∶5 C. 1∶2 D. 18∶8
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1mol·L-1的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列的顺序是________(用字母编号填写)。
(2)常温下,0.1mol·L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是___(填字母)。
A.c(H+)
B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-)
D.c(OH-)/c(H+)
E.c(H+)·c(CH3COO-)/c(CH3COOH)
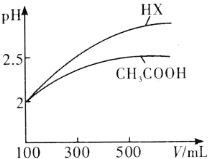
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
(4)标准状况下,将1.12L CO2通入100mL 1mol·L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c(OH-)=2c(H2CO3)+________;
②c(H+)+c(Na+)=________。
(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Al2H6燃烧热极高,是一种很好的生氢剂,它跟水反应生成H2,球棍模型如图(白球为Al,黑球为H)。下列推测肯定不正确的是

A. 该物质与水反应,属于氧化还原反应
B. Al2H6分子中氢为+1价,铝为﹣3价
C. Al2H6在空气中完全燃烧,产物为氧化铝和水
D. 氢铝化合物可能成为未来的储氢材料和火箭燃料
查看答案和解析>>
科目: 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3↓
Cr(OH)3↓
已知转换过程中的反应为:2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol·L-1,应调溶液的pH=5
查看答案和解析>>
科目: 来源: 题型:
【题目】体积为1L干燥容器中充入HCl气体后,测得容器中气体对氧气的相对密度为1.082。将此气体倒扣在水中,进入容器中液体的体积是
A. 0.25L B. 0.5L C. 0.75L D. 1L
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 pH=5时沉淀完全).其中分析错误的是
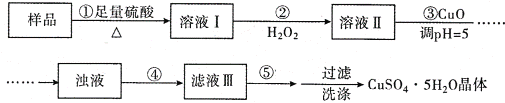
A. 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B. 步骤②不能用氯水、硝酸等强氧化剂代替H2O2
C. 步骤③用 CuCO3代替CuO也可调节溶液的pH
D. 步骤④为过滤,步骤⑤蒸发结晶
查看答案和解析>>
科目: 来源: 题型:
【题目】以惰性电极电解CuSO4和NaCl的混合溶液,两电极上产生的气体(标准状况下测定)体积如下图所示,下列有关说法正确的是
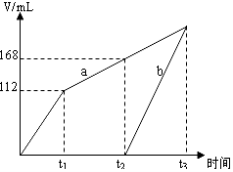
A.a表示阴极上产生的气体,t1前产生的为Cl2
B.原溶液中CuSO4和NaCl物质的量之比为1:1
C.若t2时溶液的体积为1 L,此时溶液的pH为13
D.若原溶液体积为1 L,则原溶液中SO42的物质的量浓度为0.2 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com