
科目: 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是( )
A.Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
B.Al2O3是两性氧化物,可用作耐高温材料
C.SiO2硬度大,可用于制造光导纤维
D.NH3易溶于水,可用作制冷剂
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
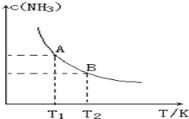
(1)当温度由T1变化到T2时,平衡常数关系K1___________K2(填“>”,“<”或“=”),焓变△H___________0(填“>”或“<”)。
(2)该反应在T1温度下5.0min达到平衡,这段时间内N2的化学反应速率为_________,N2的转化率___________。
(3)T1温度下该反应的化学平衡常数K1=______________。
(4)T1温度时,若测得高炉中c(N2)=0.5mol/L,c(H2)=0.5mol/L,c(NH3)=0.5mol/L,在这种情况下,该反应是否处于平衡状态___________(填是或否),此时反应速率是v正___________v逆(填>,<,=)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,把试管放入盛有25 ℃饱和石灰水的烧杯中,试管中开始放入几小块镁条,再滴入5 mL的稀盐酸。
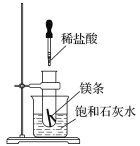
回答下列问题:
(1)实验中观察到的现象是____________________________________________。
(2)产生上述现象的原因是_________________________________________________。
(3)写出有关反应的离子方程式_________________________________________。
(4)由实验推知,MgCl2溶液和H2的总能量______(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目: 来源: 题型:
【题目】在T℃条件下,向1L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应: 2X(g) + Y(g) ![]() a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)化学计量数a的值为____________________;此反应的逆反应△S__________0 (填﹤,﹥,﹦)。
(2)下列说法中能说明该反应达到了化学平衡状态的是___________________________。
A、容器内压强一定 B、v(X)正=2 v (Y)逆
C、容器内Z分子数一定 D、容器内气体的质量一定
E、容器内气体的密度一定 F:X、Y、Z、W的浓度之比为2∶1∶a∶1
(3)维持温度不变,若起始时向该容器中加入的物质的量如下列各项,则反应达到平衡后(稀有气体不参与反应),与之是等效平衡的是______________。
A.2 mol X、1mol Y、1mol Ar B.a mol Z、1mol W
C.1 molX、0.5mol Y、0.5a mol Z、0.5 mol W D.2 mol X、1mol Y、1mol Z
(4)维持温度不变,若起始时向容器中加入4mol X和6 mol Y,若达平衡时容器内的压强减小了15%,则反应中放出的热量为___________________kJ。
(5)已知:该反应的平衡常数随温度的变化如下表:
温度/℃ | 150 | 200 | 250 | 300 | 350 |
平衡常数K | 9.94 | 5.2 | 1 | 0.5 | 0.21 |
试回答下列问题:
若在某温度下,2 mol X和1 mol Y在该容器中反应达平衡, X的平衡转化率为50%,则该温度为__________________℃。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列装置属于原电池的是________。
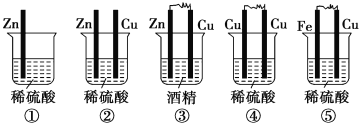
(2)在选出的原电池中,________是负极,发生________反应,________是正极,该极的现象是______________________________。
(3)此原电池反应的化学方程式为_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素A、B、C、D,A元素的原子最外层电子数是内层电子数的两倍,B为地壳中含量最多的元素,C是原子半径最大的短周期主族元素,C与D形成的离子化合物CD是常用的调味品。填写下列空白:
(1)A B2的结构式_______________;C元素在周期表中的位置第_______周期________族
(2)B、C组成的一种化合物与水发生化合反应的化学方程式为:____________________
(3)如图所示,电解质a溶液为含有CD的饱和溶液。X为石墨电极,Y为铁电极,接通直流电源。
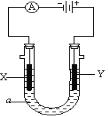
X电极的电极反应式为________________________。
Y电极的电极反应式为________________________。
(4)常温下,相同体积的0.2mol·L—1CD溶液与0.1mol·L—1 C2AB3溶液中,总离子数目较多的是______________溶液(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,向容积为2 L的恒容密闭容器中充入6molCO2 和8molH2,发生反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H= -49.0kJmol-1,测得n(H2)随时间的变化如曲线Ⅰ所示。下列说法正确的是
CH3OH(g)+H2O(g) △H= -49.0kJmol-1,测得n(H2)随时间的变化如曲线Ⅰ所示。下列说法正确的是
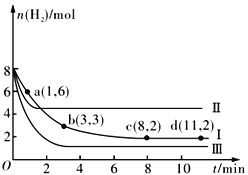
A. 该反应在0~8 min内CO2 的平均反应速率是0.375mol·L-1·min-1
B. 保持温度不变,若起始时向上述容器中充入4molCO2、2molH2、2molCH3OH(g)和1mol H2O(g),则此时反应向正反应方向进行
C. 保持温度不变,若起始时向上述容器中充入3molCO2 和4molH2,则平衡时H2 的体积分数等于20%
D. 改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com