
科目: 来源: 题型:
【题目】反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。

(1)该反应是_________反应(填“吸热”、“放热”)。
(2)反应体系中加入催化剂对反应热是否有影响?___(填“有”、“无”),原因是_______。
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 _______, E2 ______(填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某温度下,向2m g 16%的CuSO4溶液中加入m g CuSO45H2O,溶液恰好达到饱和,该饱和溶液中CuSO4的质量分数为_____。
(2)标准状况下,1体积水可溶解V体积HCl气体,所得溶液的密度为ρg/cm3,则所得溶液溶质的质量分数表示为_____,溶质的物质的量浓度表示为_____。
(3)若以ω1和ω2分别表示浓度为a molL﹣1和b molL﹣1硫酸溶液的溶质的质量分数,且知 2a=b,则下列推断正确的是(硫酸溶液的密度比纯水的大)_____(填序号)
A. 2ω1=ω2 B. ω2<2ω1 C. ω2>2ω1 D. ω1<ω2<2ω1
(4)若以ω1和ω2分别表示浓度为a molL﹣1和b molL﹣1氨水的溶质的质量分数,且知2ω1=ω2,则下列推断正确的是(氨水的密度比纯水的小)_____(填序号)
A. 2a=b B. 2a<b C. 2a>b D. a<b<2a.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列A、B、C、D是中学常见的混合物分离或提纯的基本装置.
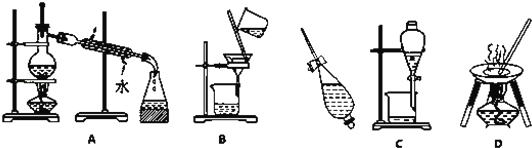
请根据混合物分离或提纯的原理,将A、B、C、D 填入适当的空格中.
(1)用四氯化碳碘水中提取碘_____;
(2)除去粗盐中的泥沙_____;
(3)与海水晒盐原理相似的是_____;
(4)分离CCl4(沸点:76.75℃)和甲苯(沸点:110.6℃)的混合物_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】在制电路板时常用氯化铁溶液作为“腐蚀液”。发生反应的化学方程式如下2FeCl3+Cu=2FeCl2+CuCl2,下列有关说法正确的是( )
A.该化学反应属于置换反应B.该化学反应中FeCl3作还原剂
C.反应中Cu失去电子D.反应过程中所有元素的化合价都发生了变化
查看答案和解析>>
科目: 来源: 题型:
【题目】同温同压下等质量的SO2和CO2相比较,下列各项正确的是( )
A. 原子个数之比为1:1B. 物质的量之比为1:1
C. 体积之比为11:16D. 分子数之比为1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】以Cl2、NaOH、CO(NH2)2 (尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。

(1)如图表示用石墨作电极,在一定条件下电解饱和食盐水制取Cl2时,阳极上产生也会产生少量的ClO2的电极反应式:________________________________;电解一段时间,当阴极产生标准状况下气体112 mL时,停止电解,则通过阳离子交换膜的阳离子物质的量为________mol。
(2)步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(3)步骤Ⅱ合成N2H4·H2O的装置如下图所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_________________;使用冷凝管的目的是_________________________________。
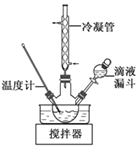
(4)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3,欲测定亚硫酸钠产品的纯度设计如下实验方案,并进行实验。准确称取所得亚硫酸钠样品m g于烧杯中,加入适量蒸馏水配成100 mL待测溶液。移取25.00 mL待测溶液于锥形瓶中,用c mol·L-1酸性KMnO4标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(假设杂质不反应)。样品中亚硫酸钠的质量分数为__________(用含m、c、V的代数式表示)。某同学设计的下列滴定方式中,合理的是________(夹持部分略去)(填字母序号)

查看答案和解析>>
科目: 来源: 题型:
【题目】分类是学习和研究化学的一种重要方法,下列分类合理的是( )
A.K2CO3和Na2O都属于盐B.H2SO4和HNO3都属于酸
C.KOH和Na2CO3都属于碱D.Na2O和Na2SiO3都属于氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法不正确的是( )
CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法不正确的是( )
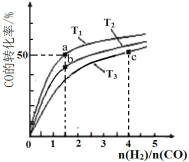
A. H2转化率:a>b>c
B. 上述三种温度之间关系为T1>T2>T3
C. a点状态下再通入0.5 mol CO和0.5 molCH3OH,平衡不移动
D. c点状态下再通入1 molCO和4 mol H2,新平衡中H2的体积分数减小
查看答案和解析>>
科目: 来源: 题型:
【题目】已知有以下物质的相互转化:

试回答:
(1)B的化学式为_____;D的化学式为_____。
(2)写出由E转变成F的化学方程式:______。
(3)常用____(填试剂名称)检验G中的阳离子,其现象为______。
(4)向G溶液中加入A的有关反应的离子方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com