
科目: 来源: 题型:
【题目】利用人工模拟光合作用合成甲酸的原理为:
2CO2+2H2O![]() 2HCOOH+O2,装置如图所示,
2HCOOH+O2,装置如图所示,
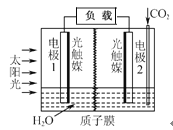
下列说法不正确的是
A.电极1周围pH增大
B.电子由电极1经过负载流向电极2
C.电极2的反应式:CO2+2H++2e-=HCOOH
D.该装置能将太阳能转化为化学能和电能
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X+Y![]() M+N反应中的能量变化过程如图,则下列有关说法正确的是
M+N反应中的能量变化过程如图,则下列有关说法正确的是
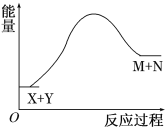
A. X的能量一定低于M的能量,Y的能量一定低于N的能量
B. 破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量
C. 因为该反应为吸热反应,故一定要加热反应才能进行
D. 加入催化剂,可减小M+N与X+Y间的能量差
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77 kJmol-1
CH3OH(g) △H3=-90.77 kJmol-1
回答下列问题:
(1)反应Ⅱ的△H2=__________,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=________(用K1、K3表示)。
(2)反应Ⅲ自发进行条件是___________(填“较低温度”、“较高温度”或“任何温度”)。
(3)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如下表所示。
温度(℃) | 500 | T |
CO2的平衡转化率 | 60℅ | 40℅ |
①T______500℃(填“高于”或“低于”)。
②温度为500℃时,该反应10 min时达到平衡:
a.用H2表示该反应的速率为____________________;
b.该温度下,反应I的平衡常数K=______________。
(4)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示。
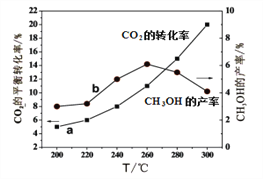
①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是_____(选填编号)。
A.升高温度 B.缩小容器体积 C.分离出甲醇 D.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而_________(填“增大”、“减小”、“不变”或“无法判断”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】固态或气态碘分别与氢气反应的热化学方程式如下:
① H2(g) +I2(?)![]() 2HI(g) △Hl=-9.48kJ/mol
2HI(g) △Hl=-9.48kJ/mol
②H2(g) +I2(?)![]() 2HI(g) △H2=+26.48kJ/mol
2HI(g) △H2=+26.48kJ/mol
下列判断不正确的是
A. ①中的I2为气态,②中的I2为固态
B. ②的反应物总能量比①的反应物总能量低
C. 反应①的产物比反应②的产物热稳定性更好
D. lmol固态碘升华时将吸热35.96kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、医药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并有带刺激性气味的气体产生。实验室合成原理为SO2+ Cl2+ SCl2=2SOCl2装置如下图所示。请回答以下问题:
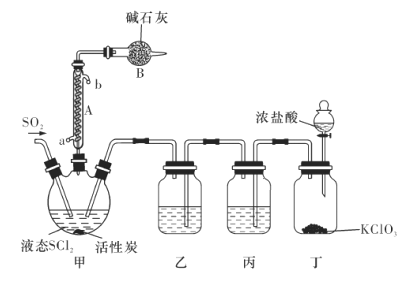
(1)仪器A的名称是________,装置乙中盛放的试剂是______装置B的作用是____________ 。
(2)装置丁中发生反应的离子方程式为___________________________。
(3)蒸干A1C13溶液不能得到无水A1C13,使SOCl2与A1C13·6H2O混合加热,可得到无水A1C13,试解释原因:_____________________________
(4)若反应中消耗的C12的体积为896 mL(已转化为标准状况下,SCl2、SO2足量),最后得到纯净的SOCl2 4.76 g,则SOCl2的产率为________(保留三位有效数字)。
(5)常温下,将0. 01 mol SOCl2加人100 mL 0. 3 mol/L NaOH溶液中恰好完全反应,所得溶液呈__________________(填“酸”“碱”或“中”)性,溶液中所有阴离子的浓度大小顺序为________________。(已知H2SO3的![]() =1 .52×10-2,
=1 .52×10-2,![]() =1.02×10-7)
=1.02×10-7)
(6)将少量SOCl2滴人5 mL 1 mol/L的AgNO3溶液中,有白色沉淀生成,该白色沉淀的成分是________________(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为![]() ,在不同的温度下该反应的平衡常数如下表:
,在不同的温度下该反应的平衡常数如下表:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是( )
A. 若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO2为0.4 mol时,该反应达到平衡状态
B. 上述反应的正反应是放热反应
C. 该反应的化学方程式是CO(g)+H2O(g) ![]() CO2(g)+H2 (g)
CO2(g)+H2 (g)
D. 若平衡浓度符合下列关系式:![]() ,则此时的温度为1000 ℃
,则此时的温度为1000 ℃
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,将打磨后的镁条放人盛有50 mL蒸馏水的烧杯中,用pH传感器和浊度传感器监测溶液中的pH和浊度随时间的变化(如图所示,实线表示溶液pH随时间的变化)。下列有关描述正确的是( )
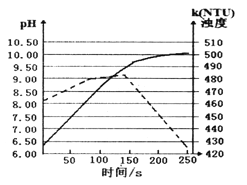
A. 该温度下Mg(OH)2的KSP的数量级约为10-10。
B. 该实验是在常温下进行的
C. 50 s时向溶液中滴人酚酞试液,溶液变红
D. 150 s后溶液浊度下降是因为生成的Mg(OH)2逐渐溶解
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,pH=7的(NH4)2SO4与NH3·H2O的混合溶液中,c(NH4+)与c(SO42-)之比是
A.小于2∶1B.大于2∶1C.等于2∶1D.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com