
科目: 来源: 题型:
【题目】在一定条件下,在密闭容器中充入1molSO2与2molNO2发生反应:SO2(g)+NO2(g) ![]() SO3(g)+NO(g) △H=-42kJ·mol-1。请回答下列问题。
SO3(g)+NO(g) △H=-42kJ·mol-1。请回答下列问题。
(1)恒温恒容下,在反应平衡体系中再充入一定量SO2,则NO2的平衡转化率__________(填“增大”、“不变”或“减小”,下同);
(2)恒温恒压下,在反应平衡体系中再充入一定量SO2,则NO2的平衡浓度_________;
(3)恒容下,升高温度,上述反应的平衡常数K为_________;
(4)恒容下,降低温度,重新达到平衡时![]() _________。
_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】苯与甲苯相比较,下列说法不正确的是
A.都能在空气燃烧产生浓烟
B.苯不能使酸性的高锰酸钾溶液褪色,甲苯能使酸性的高锰酸钾溶液褪色
C.都不能因反应而使溴水褪色
D.苯比甲苯更容易与硝酸反应
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、研究NO2、SO2、CO等大气污染气体的处理具有重要意义
(1)已知:2SO2(g) + O2(g)![]() 2SO3(g) ΔH= —Q1 kJ·mol-1 ;2NO(g) + O2(g)
2SO3(g) ΔH= —Q1 kJ·mol-1 ;2NO(g) + O2(g)![]() 2NO2(g) ΔH= —Q2kJ·mol-1则反应NO2(g) + SO2(g)
2NO2(g) ΔH= —Q2kJ·mol-1则反应NO2(g) + SO2(g)![]() SO3(g) + NO(g) 的ΔH= _________________kJ·mol-1。
SO3(g) + NO(g) 的ΔH= _________________kJ·mol-1。
(2)上述反应达化学平衡的标志是_________________。
A.混合气体的总质量保持不变
B.混合气体的总压强保持不变
C.混合气体的平均相对分子质量保持不变
D.混合气体的颜色保持不变
(3)CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示,该反应ΔH _______0(填“>”或“ <”),理由__________________________________。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示,该反应ΔH _______0(填“>”或“ <”),理由__________________________________。

Ⅱ、甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
①:CH4 ( g ) + H2O ( g ) =CO ( g ) + 3H2 ( g ) △H =+206.0 kJ·mol-1
②:CO ( g ) + 2H2 ( g ) = CH3OH ( g ) △H=—129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为_________________________。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图。
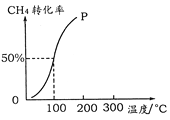
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为_____________。
②100℃时反应I的平衡常数为___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:
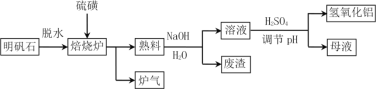
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S ![]() 2Al 2O3 +9SO2,该反应的氧化剂是______________,若生成1molAl2O3,则转移的电子数为____________________。
2Al 2O3 +9SO2,该反应的氧化剂是______________,若生成1molAl2O3,则转移的电子数为____________________。
(2)将标况下1.12L炉气通入100mL 0.5mol·L-1 NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为___________________________________。
(3)熟料溶解时反应的离子方程式为_________________________。
(4)母液中溶质主要成分的化学式为____________、_____________,溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是 ________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应化学平衡常数的表达式:K=_______________________________;
(2)该反应为________(填“吸热”或“放热”)反应;
(3)下列说法中能说明该反应达平衡状态的是__________
A、容器中压强不变
B、混合气体中c(CO)不变
C、混合气体的密度不变
D、c(CO) = c(CO2)
E、单位时间内生成CO的分子数与生成H2O的分子数相等
(4)某温度下,各物质的平衡浓度符合下式:c(CO2)×c(H2)=c(CO)×c(H2O),试判此时的温度为__________℃。
查看答案和解析>>
科目: 来源: 题型:
【题目】异秦皮啶具有抗肿瘤功效,秦皮素具有抗痢疾杆菌功效。它们在一定条件下可发生转化,如图所示。有关说法正确的是
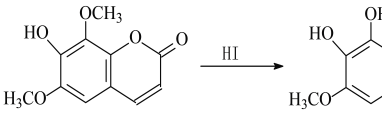
A. 异秦皮啶分子式为C11H10O5
B. 异秦皮啶与秦皮素互为同系物
C. 鉴别异秦皮啶与秦皮素可用FeCl3溶液
D. 1 mol秦皮素最多可与3 mol NaOH反应
查看答案和解析>>
科目: 来源: 题型:
【题目】根据所学内容填空:
Ⅰ.化学反应 2A+B2C;△H<0达到化学平衡时,根据以下条件改变填空:
(1)若A、B、C都是气体,且C为有色气体.
①使密闭容器体积增大,A的转化率_______;(填增大、减小、不变)
②如果升高温度,平衡混合物的颜色______;(填加深、变浅、不变)
(2)若A、C为气体,B为固体;
①加压,则A的体积分数________;(填增大、减小、不变)
②增加B的量,A的转化率_______.(填增大、减小、不变)
Ⅱ.(1)H2S溶于水的电离方程式为________________________。向H2S溶液中加入NaOH固体时,c(H+)_________,c(S2-)__________。(填增大、减小或不变)
(2) 下列物质能导电且属于电解质的是________(填序号)。
A.铁 B.盐酸 C.氯化钠晶体 D.熔融氢氧化钠
(3)23g C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出683.4 kJ热量,写出该反应的热化学方程式_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中不正确的是
A. 常温常压下,将0.1mol的NO与0.1molO2混合,则混合气体中含有原子数为0.4NA
B. 常温常压下,3g乙烷中所含极性共价键数0.7NA
C. 6g![]() 中所含中子数为3 NA
中所含中子数为3 NA
D. 标准状况下,2.24 L Cl2与0.1molH2混合,则混合气体中含有分子数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com