
科目: 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如下图所示,对该反应的推断合理的是( )
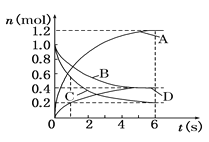
A. 该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B. 反应进行到1 s时,v(A)=v(D)
C. 反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D. 反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,10.0mL 下列气态有机物在 50.0mL O2中充分燃烧后,将生成的气体混合物通过足量浓硫酸,剩余35.0mL 的气体混合物(反应前后压强相等),则该有机物可能是
A. C3H8OB. C2H6O2
C. C4H10O2D. C6H6
查看答案和解析>>
科目: 来源: 题型:
【题目】将固体NH4Br置于密闭容器中,在某一温度下,发生下列反应:NH4Br![]() NH3(g) + HBr(g) ; 2HBr
NH3(g) + HBr(g) ; 2HBr![]() H2(g) + Br2(g) ,两分钟后测知H2为0.5mol/L ,HBr为4mol/L ,若NH4Br 的分解速率用v(NH3)表示,下列速率正确的是( )
H2(g) + Br2(g) ,两分钟后测知H2为0.5mol/L ,HBr为4mol/L ,若NH4Br 的分解速率用v(NH3)表示,下列速率正确的是( )
A. 0.5mol·L-1·min-1 B. 2.5 mol·L-1·min-1
C. 2mol·L-1·min-1 D. 1.2 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】3 mol A和2.5 mol B混合于2 L密闭容器中,发生的反应如下:3A(g)+B(g) ![]() xC(g)+2D(g),5 min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L·min),下列结论正确的是
xC(g)+2D(g),5 min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L·min),下列结论正确的是
A. A的平均反应速率为 0.1 mol/(L·min)
B. 平衡时,C的浓度为 0.125 mol/L
C. 平衡时,B的转化率为 20%
D. 平衡时,容器内压强为原来的 0.8 倍
查看答案和解析>>
科目: 来源: 题型:
【题目】已知可逆反应2NO(g)![]() N2(g)+O2(g)。若在某温度下达到平衡时C(N2)=0.05mol·L-1,C(O2)=0.05mol·L-1,c(NO)=0.1mol·L-1 该反应的平衡常数为_____________,保持温度不变,将容器体积缩小一半,则平衡常数_________(填增大、减小或不变)。
N2(g)+O2(g)。若在某温度下达到平衡时C(N2)=0.05mol·L-1,C(O2)=0.05mol·L-1,c(NO)=0.1mol·L-1 该反应的平衡常数为_____________,保持温度不变,将容器体积缩小一半,则平衡常数_________(填增大、减小或不变)。
查看答案和解析>>
科目: 来源: 题型:
【题目】CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用。
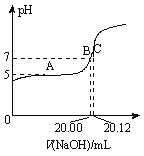
I.(1)常温下中和100 mL pH=3的CH3COOH溶液和1 L pH=4的CH3COOH溶液,需要等物质的量浓度的NaOH溶液的体积分别为V1和V2,则V1_______V2(填“>”、“=”或“<”) ;
(2)常温下,用0.1000 mol/L的NaOH溶液滴定20.00 mL某未知浓度的CH3COOH溶液,滴定曲线如图所示。其中A点所示溶液中c(CH3COO-)=2c(CH3COOH),C点所示溶液中存在c(CH3COO-)+c(CH3COOH)=c(Na+)。则常温下CH3COOH的电离常数Ka=_________,CH3COOH溶液的实际浓度为____________;
Ⅱ.1100℃时,体积为2 L的恒容容器中发生如下反应:
Na2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g)。
Na2S(s)+4H2O(g)。
(1)下列能判断反应达到平衡状态的是________;
A.容器中压强不变
B.混合气体密度不变
C.1 mol H-H键断裂同时形成2 mol H-O
D.H2的体积分数不变
(2)若2 min时反应达平衡,此时气体质量增加8 g,则用H2表示该反应的反应速率为___________;
(3)某温度下该反应达平衡状态,测得混合气体的平均相对分子质量为14,则该温度下的平衡常数K为_____________;
(4)若降低温度,K值减小,则反应的ΔH______0(填“>”或“<”) ;
(5)若反应达平衡后,加入少量的H2,再次平衡后,H2O的体积分数___________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(化学—选修5:有机化学基础)
绿原酸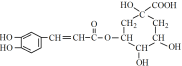 是一种抗氧化药物,存在下图转化关系。
是一种抗氧化药物,存在下图转化关系。
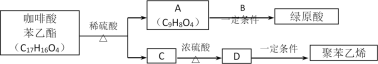
(1)绿原酸中的含氧官能团有:__________________________________。
(2)B的分子式是_____________________。
(3)C的氧化产物能发生银镜反应,则C的名称________________,写出C→D的化学方程式是______________________。
(4)咖啡酸苯乙酯的结构简式是___________________________________。
(5)F是A的同分异构体。F分别与碳酸氢钠溶液或新制Cu(OH)2反应产生气体或红色沉淀;苯环上只有两个取代基,且核磁共振氢谱表明该有机物中有8种不同化学环境的氢。
①符合上述条件的F有________种可能的结构。
②若F还能与NaOH在常温下以物质的量之比1∶2完全反应,其化学方程式是______(任写1个)。
查看答案和解析>>
科目: 来源: 题型:
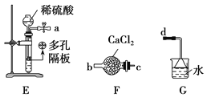
【题目】氯化亚铁具有独有的脱色能力,适用于染料、染料中间体、印染、造纸行业的污水处理。某课题小组设计如下方案制备氯化亚铁并探究氯化亚铁(Fe2+)的还原性。
方案Ⅰ:甲同学设计如下装置制备氯化亚铁。
已知:实验室常用氯化钠固体与浓硫酸共热制备氯化氢;氯化亚铁能与水蒸气剧烈反应。
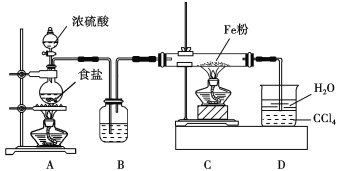
(1)写出A中反应的化学方程式: _______________。B中盛装的试剂为____________________,D装置中四氯化碳的作用是_____________。
(2)实验过程中,观察到D中现象是___________________________________________。
用物理方法检验氯化亚铁产品中是否混有铁粉:______________。
(3)上述方案有明显不足,请你提出改进上述方案的建议:______________________。方案Ⅱ:乙同学选择下列装置用氯化铁制备少量氯化亚铁(装置可以重复使用,氯化铁遇水剧烈水解)。查阅资料知,在加热条件下,氢气还原氯化铁生成氯化亚铁和氯化氢。
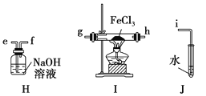
(4)气流从左至右,装置接口连接顺序是a______________________________________。
(5)设计简单实验证明氢气和氯化铁已发生反应:__________________________________。
(6)为了探究上述实验制备的氯化亚铁(Fe2+)具有还原性,设计如下方案:
a.取少量氯化亚铁样品溶于蒸馏水,滴加酸性高锰酸钾溶液,观察现象
b.取少量氯化亚铁样品溶于蒸馏水,滴加酸化的双氧水和KSCN溶液,观察现象
c.取少量氯化亚铁样品溶于蒸馏水,滴加铁氰化钾溶液,观察现象
d.取少量氯化亚铁样品溶于蒸馏水,先加KSCN溶液,后加氯水,观察现象
上述方案合理的是________(填代号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,不正确的是
A. 利用Cu与FeCl3溶液的反应制作印刷电路板
B. 燃着的镁条可以在二氧化碳气体中继续燃烧
C. 灼热的铜丝放入盛有干燥氯气的集气瓶中燃烧生成蓝色的烟雾
D. 钠能从钛、锆等金属的氯化物中置换出金属单质
查看答案和解析>>
科目: 来源: 题型:
【题目】在粗盐提纯的实验中,每一步中玻璃棒的作用分别是:
溶解(_______) 过滤(_______) 蒸发(_______)
A.引流 B.搅拌,加速固体溶解 C.转移固体 D.搅拌,防止液滴飞溅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com