
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 44gCO2与C3H8的混合物中含有共用电子对数为9NA
B. 将标准状况下2.24LSO2通入水中完全溶解,溶液中HSO32-与SO32-总数为0.1NA
C. 硝酸与铜反应得到NO2、N2O4共23g,则铜失去的电子数为0.5NA
D. 标准状况下,8.96L的平均相对分子质量为3.5的H2与D2混合物中含中子数0.3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向0.1 mol/L的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中不正确的是
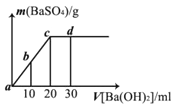
A. 溶液的pH:a<b<c<d
B. 溶液的导电能力:a>b>d>c
C. a、b溶液呈酸性
D. c、d溶液呈碱性
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物w用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下:

已知![]()
请回答下列问题
(1)F的名称是__________⑤的反应类型是__________。
(2)E中的含氧官能团的名称为__________,W的结构简式为__________。
(3)反应②的化学方程式是__________。
(4)D自身还能发生聚合反应,其聚合产物的结构简式为__________。
(5)参照有机物W的上述合成路线,设计以M为起始原料制备F的合成路线(其他试剂任选) __________。
示例:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() BrCH2CH2Br
BrCH2CH2Br
查看答案和解析>>
科目: 来源: 题型:
【题目】某食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的碳酸钠溶液;②加入稍过量的氢氧化钠溶液;③加入稍过量的氯化钡溶液;④滴入稀盐酸至无气泡产生;⑤过滤;正确的操作顺序是
A.③②⑤①④B.①②③⑤④C.②③①⑤④D.③⑤②①④
查看答案和解析>>
科目: 来源: 题型:
【题目】下列电离方程式正确的是
A. NaHCO3=Na++H++ CO32- B. H2SO3![]() 2H++SO32-
2H++SO32-
C. Ba(OH)2=Ba2+ + 2OH- D. AgCl ![]() Ag++Cl-
Ag++Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒等多种元素构成薄膜太阳能电池。回答下列问题:
(1)基态亚铜离子(Cu+)的价层电子排布式为__________。
(2)砷、硒是第四周期的相邻元素,已知砷的第一电离能(947kJ·mo1-1)大于硒(941k]·mol-l)。请从原子结构的角度加以解释__________。
(3)H2O的沸点高于H2Se的沸点,其原因是__________。
(4)GaCl3和AsF3的分子立体构型分别是__________,__________。
(5)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4] -中B原子的杂化类型为__________。
②[B(OH)4] -的结构式为__________。
(6)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。

①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是__________(用化学式表示)
②金刚石的晶胞参数为apm(lpm=10-12m),1cm3晶体的平均质量为__________g(只要求列算式,阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中错误的是( )
A. 从1L 1mol·L-1的NaCl溶液中取出10mL,其浓度仍是1mol·L-1
B. 制成0.5L 10mol·L-1的盐酸,需要氯化氢气体112L(标准状况)
C. 0.5L 2mol·L-1 BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D. 10g 98%硫酸(密度为1.84g·cm-3)与10mL 18.4mol·L-1硫酸的浓度是不同的
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿主要成分为钛酸亚铁( FeTiO3),其中一部分Fe2+在风化过程中会转化为+3价。
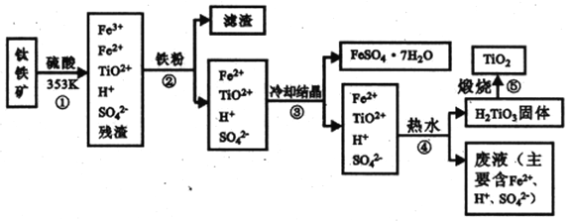
已知:TiO(OH)2(即H2TiO3)为两性氢氧化物
(1)步骤②中,发生主要反应的离子方程式为__________。
(2)步骤③中,实现混合物的分离是利用物质的__________填字母序号)。
A.熔沸点差异 B.溶解性差异 C.氧化性、还原性差异
(3)步骤②、③、④中,均需用到的操作是__________(填操作名称)。
(4)请结合化学用语,用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理:__________。
(5)上述工艺流程中可以循环利用的物质是__________
(6)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
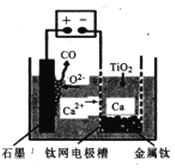
①写出阳极所发生反应的电极反应式__________。
②在制备金属Ti前后,CaO的质量将__________(填“增大”、“不变”或“减小”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)甲醇是一种重要的化工产品,可利用甲醇催化脱氢制备甲醛。甲醛与气态甲醇转化的能量关系如图所示。

反应过程中的能量关系
①甲醇催化脱氢转化为甲醛的反应是________(填“吸热”或“放热”)反应。
②过程Ⅰ与过程Ⅱ的反应热是否相同?____________原因是_______________。
③写出甲醇催化脱氢转化为甲醛的热化学反应方程式_________________________________。
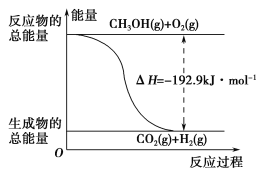
(2)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是________。
A.CH3OH转变成H2的过程一定要吸收能量
B.①反应中,反应物的总能量高于生成物的总能量
C.根据②推知反应:CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
D.反应②的能量变化如图所示
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com