
科目: 来源: 题型:
【题目】下列各组离子中,能在强酸性溶液中大量共存的是
A. Na+、K+、SO42-、OH- B. Na+、K+、Cl-、HCO3-
C. Na+、Cu2+、CO32-、Br- D. Na+、Mg2+、NO3-、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】勒夏特列原理在生产生活中有许多重要应用。完成下列填空:
(1)实验室配置FeCl3溶液时,将FeCl3溶解在盐酸中,目的是防止________________________。
(2)石蕊(用HZ表示)试液中存在的电离平衡HZ(红色)![]() H++Z—(蓝色)。在中性溶液中。石蕊试液呈__________色;要使石蕊试液呈红色,可加入____________________________。
H++Z—(蓝色)。在中性溶液中。石蕊试液呈__________色;要使石蕊试液呈红色,可加入____________________________。
(3)工业制硫酸时,为使SO2尽可能多地转化成SO3,采取的措施是_______________________。
(4)合成氨工业采取的以下措施中,可以用勒夏特列原理解释的是_________(选填编号)。
a.升温至500℃左右 b.使用催化剂
c.加压至20~50MPA. d.将氨及时液化分离
查看答案和解析>>
科目: 来源: 题型:
【题目】英国曼彻斯特大学科学家安德烈·海姆和康斯坦丁·诺沃肖洛夫。共同工作多年的二人因“突破性地”用撕裂的方法成功获得超薄材料石墨烯而获奖。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型示意图如下:
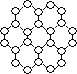
(1)下列有关石墨烯说法正确的是________________。
A.键长:石墨烯>金刚石
B.石墨烯分子中所有原子可以处于同一平面
C.12g石墨烯含![]() 键数为NA
键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①铜原子在基态时,在有电子填充的能级中,能量最高的能级符号为_____________;第四周期元素中,最外层电子数与铜相同的元素还有________________________。
②乙醇的沸点要高于相对分子质量比它还高的丁烷,请解释原因______________________________。
③下列分子属于非极性分子的是__________________。
a.甲烷 b.二氯甲烷 c.苯 d.乙醇
④酞菁与酞菁铜染料分子结构如图,酞菁分子中碳原子采用的杂化方式是__________;酞菁铜分子中心原子的配位数为________________。
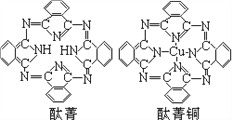
⑤金与铜可形成的金属互化物合金(如图,该晶胞中,Au占据立方体的8个顶点):
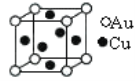
它的化学式可表示为_____;在Au周围最近并距离相等的Cu有_____个,若2个Cu原子核的最小距离为d pm,该晶体的密度可以表示为___________________g/cm3。(阿伏伽德罗常数用NA表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】在容器体积可变的密闭容器中,反应N2(g)![]() 3H2(g)
3H2(g) ![]() 2NH3(g)在一定条件下达到平衡。
2NH3(g)在一定条件下达到平衡。
完成下列填空:
(1)若该反应经过2秒钟后达到平衡,NH3的浓度增加了0.4mol/L,在此期间,正反应速率![]() (H2)的值为(_______)
(H2)的值为(_______)
A 0.6mol/(L·s) B 0.45 mol/(L·s) C 0.3 mol/(L·s) D 0.2 mol/(L·s)
(2)在其他条件不变的情况下,增大容器体积以减小反应体系的压强,![]() ____(选填“增大”、“减小”,下同),
____(选填“增大”、“减小”,下同),![]() ____,平衡向____方向移动(选填“正反应”、“逆反应”)。
____,平衡向____方向移动(选填“正反应”、“逆反应”)。
(3)在其他条件不变的情况下,升高温度平衡向逆反应方向移动,则正反应为____反应(选填“吸热”、“放热”)。
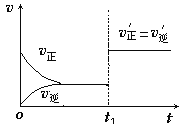
(4)如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是___(填写编号)。
a.增大H2的浓度 b.缩小容器体积 c.加入催化剂 d.升高温度
改变条件后,平衡混合物中NH3的百分含量____(选填“增大”、“减小”、“不变”)。在一定条件下,反应2A+B![]() C达到平衡。
C达到平衡。
(5)若升高温度,平衡向正反应方向移动,则逆反应是_________热反应;
(6)若增加或减少B时,平衡不移动,则B是_________态;
(7)若A、B、C均为气态,将6mol A、3mol B充入容积为0.5L的密闭容器中,进行反应。经5s后,测得容器内有1mol B,则用A表示的反应速率为_________________________, 5s末时C的物质的量浓度为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A. 胶体属于纯净物
B. 可用丁达尔效应区分胶体与溶液
C. 氢氧化铁胶体能吸附水中的悬浮颗粒并沉降而用于净水
D. 胶体分散质粒子的直径在10-9~10-7m之间
查看答案和解析>>
科目: 来源: 题型:
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__________。
(2)用盐酸酸浸时发生反应的离子方程式为: __________。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有_____________________。
②如何证明晶体已洗净?_______________________。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:_______________。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为__________ mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)将下列现象中硫酸表现出来的性质填写在空格内:敞口放置的浓硫酸,溶液质量增加_________________;浓硫酸与蔗糖放出大量热,并出现黑色固体____________;
(2)将一瓶二氧化硫和一瓶硫化氢气体瓶口对接进行混合,瓶壁上能观察到有_________________和_________________生成,其化学反应方程式为:____________________________ , 此反应中SO2作____________剂, 1 mol 二氧化硫和硫化氢完全反应时,有_________mol电子发生转移。
(3)当雨水的pH________时,我们称之为“酸雨”。某环保小组测定某次雨水中硫酸的物质的量浓度为5×10-6 mol/L,这次雨__________酸雨(选填“属于”或“不属于”)。常温下若把0.1mol/L的盐酸溶液稀释100倍,此时的溶液的pH=__________。
(4)将一充满氨气的大试管倒立在水槽中,可以看到现象_________________,说明_______________,若在此溶液中滴入酚酞试液,溶液呈_______色,其电离方程式___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 可用蒸发结晶的方法从碘水中提取碘单质
B. 碘化银可用于人工降雨
C. 酒精在实验台上着火可用水作灭火剂
D. 氢气还原氧化铜要先加热再通氢气
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=0.2/t1mol·L-1·min-1
B. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com