
科目: 来源: 题型:
【题目】下列各溶液中,Na+物质的量浓度最大的是
A. 4L 0.5mol/LNaCl溶液 B. 1L 0.3mol/LNa2SO4溶液
C. 5L 0.4mol/LNaOH D. 2L 0.15mol/LNa3PO4
查看答案和解析>>
科目: 来源: 题型:
【题目】有一处于平衡状态的反应:X(s)+3Y(g)![]() 2Z (g),ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z (g),ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
A. ①③⑤ B. ②③⑤ C. ②③⑥ D. ②④⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】Ni2O3是灰黑色、有光泽的固体,主要用作陶瓷、搪瓷和玻璃的着色颜料,也可用于制备镍粉。以废镍料为原料提取Ni2O3的工艺流程如图所示。

请回答下列问题:
(1)镍的某种化合物NiOOH,其中Ni的化合价为___________。
(2)加入双氧水“氧化”的离子方程式为____________________;滤渣A的主要成分是________________(填化学式)。
(3)步骤①中为了控制“氧化”效率,最佳物质的量之比NaOH/NaClO =________。
(4)步骤②电解法制取Ni2O3,用NaOH调酸溶后溶液的pH至7.5,加入适量Na2SO4后以惰性电极电解。电解过程中产生的Cl2有约40%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。加入Na2SO4的作用__________________________;当有n mol二价镍全部转化为三价镍时,外电路中通过电子的物质的量约为____________。
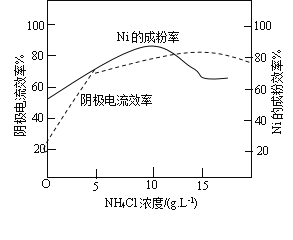
(5)工业上,镍作阳极,电解0.1molL-1NiCl2溶液与一定量NH4Cl溶液组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率(电极上实际沉积的物质的量与理论析出量之比)及Ni的成粉的影响如图所示。
① 为获得高纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为__________gL-1。
② 当NH4Cl浓度大于15gL-1时,阴极有气体生成,导致阴极电流效率降低,请结合平衡移动原理解释其原因____。
查看答案和解析>>
科目: 来源: 题型:
【题目】尿素[CO(NH2)2] 是一种重要的氮肥,在工农业生产中广泛应用。
(1)工业制备尿素的反应2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)。温度为TK时,将68gNH3和88gCO2充入容积为100L的恒容密闭容器中,发生上述反应。测得平衡时CO2和H2O(g)物质的量相等。下列叙述正确的是____________。
CO(NH2)2(l)+H2O(g)。温度为TK时,将68gNH3和88gCO2充入容积为100L的恒容密闭容器中,发生上述反应。测得平衡时CO2和H2O(g)物质的量相等。下列叙述正确的是____________。
a.平衡时,NH3的浓度为0.02 molL1
b.当v(NH3)正=2v(H2O)逆时,反应达到平衡状态
c.若在恒温恒压条件下充入稀有气体,平衡发生正向移动
d.加入适当的催化剂可提高CO2的转化率
(2)尿素溶于水缓慢水解产生碳酸铵,碳酸铵溶液显碱性,原因是___________;碳酸铵溶液中离子浓度由大到小的顺序为_____________;如果将一定浓度的碳酸铵溶液加入到相同浓度的稀BaCl2和ZnCl2混合液中,首先析出的沉淀是__________。(已知Ksp(BaCO3)=5.1×10-9mol2L-2,Ksp(ZnCO3)=1.4×10-11 mol2L-2)
(3)用甲醛法可以间接测定尿素含氮量。尿素通过处理转化为铵盐,甲醛与NH4+作用,其反应如下:4NH4++6HCHO=(CH2)6N4H++3H++6H2O。所生成的H+和(CH2)6N4H+都可与NaOH溶液反应,用NaOH标准溶液滴定时采用酚酞作指示剂。
称取Wg尿素样品,经转化后得到1000mL溶液,量取25.00mL放入锥形瓶中,滴加2滴酚酞,用0.1000molL-1NaOH标准溶液滴定,滴定至终点时,消耗碱液体积20.50mL。
① 滴定至终点的现象是__________________________。
② 该尿素样品的纯度为__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将过量的0.2g铜粉与5mL1 molL1FeCl3溶液混合,充分振荡,溶液棕黄色变浅,溶液变绿,有灰白色固体出现。通过查阅资料,初步认为灰白色固体可能含CuCl(CuCl白色晶体,不溶于水、硫酸、稀硝酸,溶于氨水、浓盐酸溶液中,生成络合物)。为进一步探究灰白色固体是否含CuCl,进行一系列实验。已知:① CuCl+2NH3H2O![]() [Cu(NH3)2]++Cl+2H2O(无色溶液)② 提供的试剂:稀HNO3、AgNO3溶液、氨水、KSCN溶液
[Cu(NH3)2]++Cl+2H2O(无色溶液)② 提供的试剂:稀HNO3、AgNO3溶液、氨水、KSCN溶液
请回答下列问题:
(1)生成CuCl的化学方程式____________________________________。
(2)下列为常见的分离装置(装置中的其他仪器忽略),从上述溶液中分离出固体混合物,应选用的相应装置中的仪器名称是_______________。
A. B.
B. 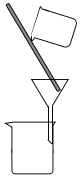 C.
C.![]() D.
D. E.
E. F.
F.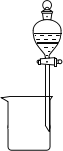
(3)提纯灰白色固体:将固体混合物用蒸馏水洗涤以除去固体表面的Fe3+、Cl。为检验固体混合物是否洗涤干净,最佳方案是检验洗涤液中是否含有_______(填离子符号),理由是_____________________________________________。
(4)设计实验检验得到的灰白色固体中含有CuCl,该实验过程中用到的试剂为____________________。
(5)实验测得灰白色固体混合物质量为a g,其中CuCl b g。上述实验过程中还有CuCl2生成,则生成CuCl2的物质的量是____________(列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A. 2CH2=CH2+O2![]() 是理想的原子经济,原子利用率为100%
是理想的原子经济,原子利用率为100%
B. 石油分馏制得汽油、煤油、柴油等产品
C. 煤干馏的产品很多,属于物理变化
D. 煤的气化主要反应是C(s)+H2O(g) ![]() CO(g)+H2(g)
CO(g)+H2(g)
查看答案和解析>>
科目: 来源: 题型:
【题目】20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(gL-1)如图所示。已知盐酸浓度大于1molL-1时,发生反应:PbCl2(s)+2Cl-(aq)═PbCl42-(aq)。下列叙述正确的是
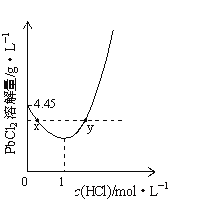
A. 盐酸浓度越小,Ksp(PbCl2)越小
B. x、y两点对应的溶液中c(Pb2+)相等
C. 当盐酸浓度为1molL-1时,溶液中c(Pb2+)一定最小
D. 当盐酸浓度小于1molL-1时,随HCl浓度增大,PbCl2溶解量减少是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】右图表示反应N2(g)+3H2(g)![]() 2NH3(g); ΔH=-92.2kJ/mol。 在某段时间t0~ t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是 ( )
2NH3(g); ΔH=-92.2kJ/mol。 在某段时间t0~ t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是 ( )

A、t0—t1 B t2—t3 C t3—t4 D t5—t6
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上可用黄铜矿(CuFeS2)冶炼铜,同时还可得到多种物质。工业冶炼铜的化学方程式是:8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
(1)CuFeS2中Fe的化合价为+2,反应中被还原的元素是氧元素和____________。
(2)用少量黄铜矿冶炼铜产生的炉渣(主要含Fe2O3、FeO、SiO2、Al2O3)模拟制铁红(Fe2O3),进行如下实验。
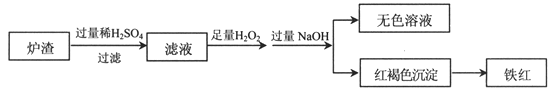
①滤液中的阳离子有Fe3+、Fe2+、H+、_____________。
②为确认滤液中含Fe2+,下列实验方案和预期现象正确的是____(填序号)。
实验方案 | 预期现象 | |
a | 加NaOH溶液 | 产生白色沉淀,变灰绿再变红褐 |
b | 先加KSCN溶液,再加氯水 | 先无明显现象,后变红 |
c | 加酸性KMnO4溶液 | 紫色褪去 |
d | 先加氯水,再加KSCN溶液 | 溶液先变黄,再变红 |
③滤液在酸性条件下,与H2O2反应的离子方程式是_________________________。
(3)m克铝热剂(氧化铁与铝)恰好完全反应,则该反应中氧化产物与还原产物的质量比是________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是元素周期表的草图,表中所列字母代号分别代表某一种元素,请回答:

(1)表中的实线表示元素周期表的左右边界,请用实线补全元素周期表的上下边界__________。
(2)表中最活泼的金属与最活泼的非金属形成的物质是__________________(填化学式)。
(3)由a、d两种元素可形成两种化合物,写出其中一种化合物分解生成另一种化合物的化学方程式:_________________________________________________________________________________,这两种化合物中所含的化学键有________(填字母)。
A 极性共价键 B 非极性共价键 C 离子键
(4)e、f、k、m对应的单原子离子的半径由大到小的顺序为__________(填离子符号)。
(5)d、m对应的离子还原性由强到弱顺序为___________________________________(填离子符号)。
(6)d、e、m的气态氢化物中,最不稳定的是________________________(填分子式)。
(7)用电子式表示n与m形成的原子个数比2∶1的化合物的形成过程:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com