
科目: 来源: 题型:
【题目】化学反应A2+ B2= 2AB的能量变化如图所示,则下列说法正确的是( )

A. 该反应是吸热反应
B. 断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量
C. 断裂2 mol A—B键需要吸收y kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
查看答案和解析>>
科目: 来源: 题型:
【题目】有些科学家提出硅是“21 世纪的能源”,这主要是由于作为半导体材料的硅在太阳能
发电过程中具有重要的作用。下列关于硅及其化合物的说法正确的是( )
A.水泥、玻璃、水晶饰物都是硅酸盐制品
B.高温下,可在试管内完成焦炭和石英砂(SiO2)制取硅的反应
C.光导纤维的主要成分是SiO2
D.自然界中硅元素的贮量丰富,并存在大量的单质硅
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法错误的是![]()
![]()
石油![]() 分馏产品
分馏产品![]() 乙烯
乙烯![]() .
.
A. 石油主要是由烃组成的混合物
B. ![]() 主要发生物理变化
主要发生物理变化
C. ![]() 包括裂化、裂解等过程
包括裂化、裂解等过程
D. ![]() 是加成反应,产物名称是二溴乙烷
是加成反应,产物名称是二溴乙烷
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,完成下列问题: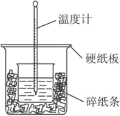
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________。请指出装置中的另外错误是 ________________________
(2)烧杯间填满碎纸条的作用是___________。
(3)大烧杯上如不盖硬纸板,求得的中和热值___________(填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL 0.50mol·L-1的盐酸跟60 mL 0.55mol·L-1NaOH溶液进行上述实验相比,所放出的热量___________(填“相等”“不相等”),所求中和热___________(填“相等”“不相等”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】铝元素对人体健康有害。因此,世界卫生组织正式把铝确定为食品污染源之一而加以控制。铝在下列场合使用时应加以控制的是( )
①制铝合金②制电线③制炊具④制银色漆颜料⑤用明矾净水⑥明矾和小苏打制食品膨松剂⑦制易拉罐⑧用氢氧化铝凝胶制胃药⑨包装糖果和小食品
A.③⑤⑧⑨B.⑥⑧⑨C.③⑤⑨D.③⑤⑥⑦⑧⑨
查看答案和解析>>
科目: 来源: 题型:
【题目】表中关于物质分类的正确组合是( )
组合类别 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
A | CO2 | SiO2 | H2SO4 | Na2CO3 | NaHCO3 |
B | CO | Na2O | HCl | NaOH | NaCl |
C | SO2 | H2O2 | CH3COOH | KOH | CaCl2 |
D | CO2 | CaO | HNO3 | Ca(OH)2 | CaCO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置.下列叙述不正确的是

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解
D. a和b用导线连接后,Fe片上发生还原反应,溶液中的Cu2+向铜电极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y、Z、W、M、N为短周期元素且原子序数依次增大,X与M、W与N分别同主族,且元素X、Y、Z、W分属两个短周期,它们四者原子序数之和为22,最外层电子数之和为16,在化合物Y2X6、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构,请回答下列问题:
(1)Y元素在周期表中的位置是____________,X、Y、Z、W、M的原子半径由大到小的顺序为:__________________________(用元素符号表示)。
(2)写出Y2X6的电子式_____;Z2X4结构式______;X2W2所含化学键的类型______。
(3)用电子式描述M2N所形成化合物的形成过程_________________________。
(4)均含X、W、M、N四种元素的两种化合物相互反应有刺激性气味气体放出,反应的离子方程式为__________________。
(5)火箭发动机曾经利用Z2X4作燃料X2W2作助燃剂,产物环保无污染,写出二者反应的方程式__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某学习小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。实验过程:
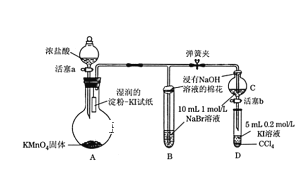
Ⅰ. 打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ. 当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ. 当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
回答问题:
(1)A中产生黄绿色气体,其电子式是_________。实验室在加热条件下制取该气体的离子方程式为____________。
(2)验证氯气的氧化性强于碘单质的实验现象是____________。
(3)C中溶液发生反应的离子方程式是_______________。
(4)过程Ⅲ实验的目的:甲同学认为试管B的作用就是吸收尾气,防止多余Cl2污染空气,因此B中盛装的最佳试剂应该为__________________________
乙同学经分析认为,B中溶液由黄色变为棕红色,发生反应为Cl2+2NaBr=2NaCl+Br2,以此说明C中________,从而得出D中氧化I-的氧化剂必为_______,因此B装置是必不可少的。
(5)过程Ⅳ为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下试管D震荡,静置,观察到的现象为______________,发生反应的离子方程式为_____________________。
(6)氯、溴、碘单质的氧化性逐渐减弱的本质原因:同主族元素从上到下_________,得电子能力逐渐减弱。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.3p2表示3p能级上有2个电子
B.处于最低能量的原子叫做基态原子
C.同一原子中,3s、3p、3d、4s 能级的能量逐渐增大
D.同一原子中,3s、3p、3d能级的轨道数依次增多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com