
科目: 来源: 题型:
【题目】A+、B2+、C-、D2-4种离子具有相同的电子层结构。现有以下排列顺序:
①B2+>A+>C->D2-②C->D2->A+>B2+③B2+>A+>D2->C-④D2->C->A+>B2+4种离子的半径由大到小以及4种元素原子序数由大到小的顺序分别是( )
A.①④B.④①C.②③D.③②
查看答案和解析>>
科目: 来源: 题型:
【题目】以Na2SO3溶液和不同金属的硫酸盐溶液为实验对象,可探究盐的性质和盐溶液间反应的多样性
实验 | 试剂 | 现象 | 检验 结果 | |
滴管 | 试管 | |||
2 mL | 0.2 mol·L1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 | 产物为Ag2SO3 |
0.2 mol·L1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | 产物含Cu+、Cu2+和SO32 | ||
0.1 mol·L1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | 产物为 Al(OH)SO3 | ||
下列说法不正确的是
A. 现象Ⅰ对应的离子方程式:Ag2SO4(s) + SO32(aq) === Ag2SO3(s) + SO42(aq)
B. 用稀硫酸证实Ⅱ沉淀中含有Cu+的实验现象是析出红色固体
C. 现象Ⅲ中白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色
D. 上述实验现象涉及了亚硫酸盐的溶解性、氧化还原性及其水溶液的酸碱性
查看答案和解析>>
科目: 来源: 题型:
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:
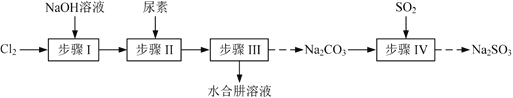
已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
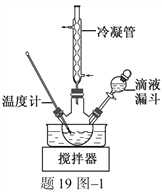
(2)步骤Ⅱ合成N2H4·H2O的装置如题19图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。
(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
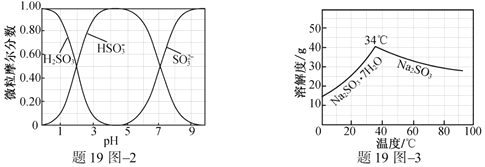
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关化学键类型的叙述正确的是( )
A.全部由非金属构成的化合物中肯定不存在离子键
B.所有物质中都存在化学键
C.已知乙炔的结构式为H—C≡C—H,则乙炔中存在2个σ键(C—H)和3个π键(C≡C)
D.乙烷分子中只存在σ键,不存在π键
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是( )
A.键能越小,表示化学键越牢固,难以断裂
B.两原子核越近,键长越长,化学键越牢固,性质越稳定
C.破坏化学键时,消耗能量,而形成新的化学键时,则释放能量
D.键能、键长只能定性地分析化学键的特性
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O)晶体,设计了如下流程:
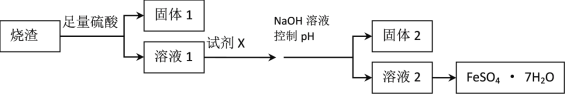
已知:(1)常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH | |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.2 |
Al3+ | 3.3 | 5.0 |
(2)七水合硫酸亚铁(FeSO4·7H2O)的溶解度
温度/℃ | 10 | 20 | 30 | 40 | 50 |
FeSO4·7H2O溶解度(g) | 15.5 | 26.5 | 32.9 | 40.2 | 48.9 |
(1)溶解烧渣选用足量硫酸,写出Fe2O3与硫酸反应的离子方程式_______________;检验溶液1中含有Fe3+的实验方法是___________________;
(2)固体1是制作单晶硅的主要原料,写出该反应的化学方程式___________________;
(3)试剂X是__________________;固体2是___________________;
(4)加入NaOH溶液控制pH应不超过_________________;
(5)从溶液2中获得晶体的的方法为______________, _____________过滤、洗涤、干燥。
查看答案和解析>>
科目: 来源: 题型:
【题目】在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子![]() 使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用
使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用![]() 表示
表示![]() 请认真观察如图,然后回答问题.
请认真观察如图,然后回答问题.

![]() 图中所示反应是______
图中所示反应是______![]() 填“吸热”或“放热”
填“吸热”或“放热”![]() 反应.
反应.
![]() 已知拆开1mol
已知拆开1mol![]() 键、1mol
键、1mol![]() 、1mol
、1mol![]() 键分别需要吸收的能量为436kJ、151kJ、
键分别需要吸收的能量为436kJ、151kJ、![]() 则由1mol氢气和1mol碘反应生成HI会______
则由1mol氢气和1mol碘反应生成HI会______![]() 填“放出”或“吸收”
填“放出”或“吸收”![]() ______kJ的热量
______kJ的热量![]() 在化学反应过程中,是将______转化为______.
在化学反应过程中,是将______转化为______.
![]() 下列反应中,属于放热反应的是______,属于吸热反应的是______.
下列反应中,属于放热反应的是______,属于吸热反应的是______.
![]() 物质燃烧
物质燃烧
![]() 炸药爆炸
炸药爆炸
![]() 酸碱中和反应
酸碱中和反应
![]() 二氧化碳通过炽热的碳
二氧化碳通过炽热的碳
![]() 食物因氧化而腐败
食物因氧化而腐败
![]() 与
与![]() 反应
反应
![]() 铁粉与稀盐酸反应.
铁粉与稀盐酸反应.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中不正确的是( )
A.双键、叁键都有π键
B.成键原子间原子轨道重叠越多,共价键越牢固
C.因每个原子未成对电子数是一定的,故配对原子个数也一定
D.所有原子轨道在空间都有自己的方向性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com