
科目: 来源: 题型:
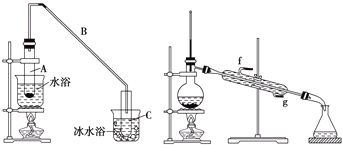
【题目】化学小组采用类似制乙酸乙酯的装置(如下图),用环己醇制备环己烯。
已知: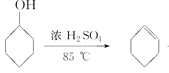 +H2O
+H2O
密度 | 熔点 | 沸点 | 溶解性 | |
环己醇 |
| 25 | 161 | 能溶于水 |
环己烯 |
|
| 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片(防止暴沸),缓慢加热至反应完全,在试管C内得到环己烯粗品。
导管B除了导气外还具有的作用是______。
②试管C置于冰水浴中的目的是______。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等![]() 加入饱和食盐水,振荡、静置、分层,环己烯在______层(填“上”或“下”),分液后用______(填入编号)洗涤。
加入饱和食盐水,振荡、静置、分层,环己烯在______层(填“上”或“下”),分液后用______(填入编号)洗涤。
A.KMnO4溶液![]() 稀H2SO4 C.Na2CO3溶液
稀H2SO4 C.Na2CO3溶液
②再将环己烯按上图装置蒸馏,冷却水从______口进入![]() 填“g”或“f”),蒸馏时要加入生石灰,其目的是______。
填“g”或“f”),蒸馏时要加入生石灰,其目的是______。
③收集产品时,控制的温应在______左右,实验制得的环己烯精品质量低于理论产量,可能的原因是_____。
A.蒸馏时从![]() 开始收集产品
开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是______。
A.分别加入酸性高锰酸钾溶液
B.分别加入用金属钠
C.分别测定沸点
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ. A、B、C、D、E均为中学化学常见的纯净物,B为最常见的液体,它们之间有如下反应关系:
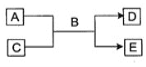
(1)若A为短周期的金属单质,D为气态单质,0.1 mol/L-1 C溶液的pH=13,则该反应的离子方程式为____________。
(2)若A的水溶液能使淀粉溶液变蓝,C为非金属氧化物,且能使品红溶液褪色,则该反应的化学方程式为___________。
(3)若A、C、D、E均为化合物,E为白色絮状沉淀,且A、C、E均含有同一种元素,则该反应的离子方程式为 ___________。
Ⅱ.(1)二氧化氯是目前国际上公认的第四代高效、无毒的光谱消毒剂,它可由KClO3和H2SO4存在下与Na2SO3反应制得。请写出该反应的离子反应方程式: ___________。
(2)过碳酸钠是一种有多种用途的新型氧系固定漂白剂,化学式可表示为Na2CO33H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了还原反应的是_________。
A. MnO2 B. KMnO4溶液 C. 稀盐酸 D. Na2SO3溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】今有浓度均为3mol·L-1的盐酸和硫酸各100mL,分别加入等质量的Fe粉,反应完毕后生成气体的质量之比为3:4,则加入盐酸中的铁粉的质量为
A. 5.6g B. 8.4g C. 11.2g D. 16.8g
查看答案和解析>>
科目: 来源: 题型:
【题目】燃烧是人类最早利用的化学反应之一,人类已有几十万年的利用燃烧反应的历史,燃烧需要具备的条件是( )
①可燃物 ②氧气(空气等助燃剂) ③温度达到着火点
A.①②B.②③C.①③D.①②③
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,通入的气体物质只作为氧化剂的是
A.二氧化硫通入溴水溶液中B.氯气通入氯化亚铁溶液中
C.一氧化碳气体通入灼热的CuO中D.二氧化氮通入水中
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关常见金属的说法错误的是
A.电解饱和食盐水可以获得金属钠
B.镁因在空气中形成了一薄层致密的氧化膜,故镁不需要像钠似的进行特殊保护
C.铝罐、铁罐可以盛装冷的浓硫酸、浓硝酸
D.铁、铜都是具有可变化合价的过渡元素
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键需要的能量分别是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_________________。
(2)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,回答下列问题:
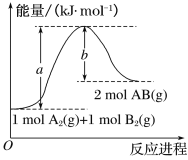
①该反应的ΔH_______0(填 “大于”“小于”或“等于”);
②反应物的总键能为______________;
③写出该反应的热化学方程式________________________________。
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH 4=-1048.9kJ/mol
写出联氨的结构式_______________,上述反应热效应之间的关系式为ΔH4=__________,联氨和N2O4可作为火箭推进剂的主要原因为_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、量筒、泡沫塑料、泡沫塑料板、胶头滴管、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是______、_______________。他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5mol·L-1HCl溶液 | 20 ℃ | 23.3 ℃ | |
② | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.5 ℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
(2)NaOH用量比HCl用量稍多的原因是_________________________________。
(3)根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: ___________________。
(4)若用KOH代替NaOH,对测定结果________(填“有”或 “无”)影响;若用醋酸代替HCl做实验,对测定结果__________(填“有”或“无”)影响。
(5)两溶液混合后,怎样搅拌溶液_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com