
科目: 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)![]() 2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:
2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:

下列说法中正确的是
A. 30~40 min间该反应使用了催化剂
B. 反应方程式中的x=1,正反应为吸热反应
C. 30 min时降低温度, 40 min时升高温度
D. 8 min前A的平均反应速率为0.08 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+nB(g) ![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )

A. 由图1可知,T1<T2,该反应正反应为吸热反应
B. 由图2可知,该反应m+n﹤p
C. 图3中,表示反应速率v正>v逆的是点3
D. 图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)![]() CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
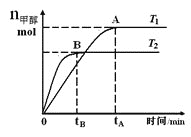
A. 平衡常数K=![]()
B. 该反应在T1时的平衡常数比T2时的小
C. CO合成甲醇的反应为吸热反应
D. 处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L 的盐酸与50mL0.55mol/L 的 NaOH 溶液在如图所示的装置中进行中和反应。 请回答下列问题:
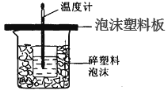
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_________;由图可知该装 置有不妥之处,应如何改正?_____。
(2)实验中改用 60 mL0.50 mol/L 的盐酸跟 50mL 0.55 mol/L 的 NaOH 溶液进行反应,与 上述实验相比,所放出的热量_____(填“相等”或“不相等”);所求中和热的数值会_____(填“相等”或 “不相等”),理由是_____。
(3)该同学做实验时有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因 是_____。
A.测量盐酸的温度后,温度计没有用水冲洗干净 B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓 C.做本实验的当天室温较高 D.在量取盐酸时仰视计数
E.将 50mL0.55mol/L 氢氧化钠溶液取成了 50mL0.55mol/L 的氨水
(4)将 V1ml 1.0mol/L HCl 溶液和 V2ml 未知浓度的 NaOH 溶液混合均匀后测量并记录温 度,实验结果如下图所示(实验中始终保持 V1+V2=50mL)
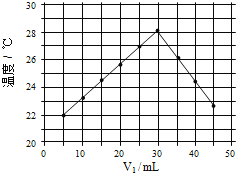
通过分析图像可知,做该实验时环境温度_____(填“高于”,“低于”或“等于”)22℃,该 NaOH 溶液的浓度约为_____mol/L。
(5)假设盐酸和氢氧化钠溶液的密度都是 1g·cm-3,又知中和反应后生成溶液的比热容 c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度 t1/℃ | 终止温度 t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.2 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.3 | 20.5 | 25.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=_____(结果保留一位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】燃煤脱硫可减少SO2尾气的排放,燃煤脱硫技术受到各界科研人员的关注。一种燃煤脱硫技术的原理是:CaO(s)+3CO(g)+SO2(g)![]() CaS(s)+3CO2(g) △H=-394.0kJ/mol。保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):
CaS(s)+3CO2(g) △H=-394.0kJ/mol。保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):
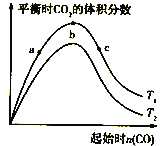
下列有关说法正确的是
A. T1比T2高 B. b点SO2转化率最高
C. b点后曲线下降是因CO体积分数升高 D. 减小压强可提高CO、SO2转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)有①168 O 、 17 8O 、 188O ;②H2、D2、T2;③石墨、金刚石;④11H 、21H、 31H;四组微粒或物质。互为同位素的是_____(填编号)。
(2)下列物质中:①N2;②MgCl2;③NH4Cl;④CH4;⑤CO2;⑥Ne;⑦H2S;⑧KOH;⑨Na2O2; ⑩K2O;只存在共价键的是_____;属于离子化合物,但含有共价键的 是_____。
(3) 用电子式表示下列物质:
MgCl2 _____; N2 _____;
NH4+_____; Na2O2 _____。
查看答案和解析>>
科目: 来源: 题型:
【题目】按如图装置进行实验,下列推断正确的是( )
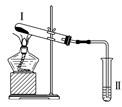
选项 | Ⅰ中试剂 | Ⅱ中试剂及现象 | 推断 |
A | 氯化铵 | 酚酞溶液不变红色 | 氯化铵稳定 |
B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成FeO和SO2 |
C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液褪色 | 石蜡油发生了化学变化 |
D | 铁粉与水蒸气 | 肥皂水冒泡 | 铁粉与水蒸气发生了反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在一个绝热、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0。下列各项能说明该反应已经达到平衡状态的是________。
2NH3(g)△H<0。下列各项能说明该反应已经达到平衡状态的是________。
A、容器内气体密度保持不变
B、容器内温度不再变化
C、断裂1mol N≡N键的同时,生成6mol N﹣H键
D、反应消耗N2、H2与产生NH3的速率之比1:3:2
(2)已知:①Zn(s)+1/2O2(g) = ZnO(s) △H =-348.3 kJ/mol
②2Ag(s)+1/2O2(g) = Ag2O(s) △H =-31.0 kJ/mol
则Zn(s)+Ag2O(s) = ZnO(s)+2Ag(s)的△H=________ kJ/mol。
(3)已知两个热化学方程式:
C(s)+O2(g)==CO2(g) △H = -393.5kJ/mol
2H2(g)+O2(g)==2H2O(g)△H = -483.6kJ/mol
现有0.2mol炭粉和H2组成悬浮气,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是________。
(4)在水溶液中,YO3n-和S2-发生反应的离子方程式如下:YO3n- + 3S2- + 6H+ = Y-+ 3S↓+ 3H2O
①YO3n-中Y的化合价是_____________;
②Y元素原子的最外层电子数是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于化学键的叙述,正确的一项是
A.离子化合物中一定含有离子键
B.单质分子中均不存在化学键
C.含有极性键的分子一定是极性分子
D.含有共价键的化合物一定是共价化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时,4v正(O2)=5v逆(NO)
B. 若单位时间内生成xmol NO的同时,消耗xmol NH3,则反应达到平衡状态
C. 若有5 mol O===O键断裂,同时有12 mol H—O键形成,此时必为化学平衡状态
D. 化学平衡时,化学反应速率关系是2v正(NH3)=3v逆(H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com