
科目: 来源: 题型:
【题目】当前,汽车尾气已成为许多城市空气的主要污染源。研究表明,含TiO2的混凝土或沥青可以部分消除汽车尾气中的氮氧化物,其原理如下:

下列关于该“消除”过程的叙述不正确的是
A. 部分光能转变为化学能
B. 消除总变化为NOx+O2+H2O→HNO3
C. 消除反应能全天候发生
D. 使用纳米TiO2的消除效率更高
查看答案和解析>>
科目: 来源: 题型:
【题目】(一)已知2A2(g)+B2(g)![]() 2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡时放出热量b kJ。
2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡时放出热量b kJ。
(1)比较a___b(填“>、=、<”)
(2)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
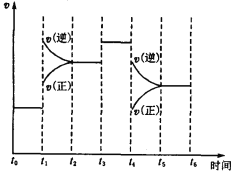
(3)下图表示此反应的反应速率v和时间t的关系图。根据下图判断,在t1和t4时刻改变的外界条件分别是_______________和 _____________ 。
(二)在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)![]() 2NH3(g);△H<0。反应中NH3的物质的量浓度的变化情况如右图所示,请回答下列问题:
2NH3(g);△H<0。反应中NH3的物质的量浓度的变化情况如右图所示,请回答下列问题:
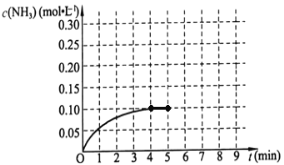
(1)根据上图,该反应达到平衡时H2的转化率等于__________。
(2)第5分钟末,保持其它条件不变,若改变反应温度,达新平衡后NH3的物质的量浓度不可能为_________。(填序号)。
a 0.20mol·L-1 b 0.12 mol·L-1 c 0.10 mol·L-1 d 0.08 mol·L-1
(3)若在第5分钟末将容器的体积缩小一半后,在第8分钟达到新的平衡(此时NH3的浓度约为0.25 mol·L-1 ),请在上图中画出第5分钟到9分钟NH3浓度的变化曲线。____________
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g) +2H2(g) ![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
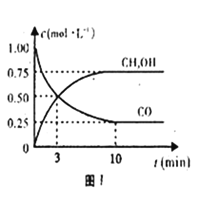
(1)图1是表示一定温度下,在体积为2L的密闭容器中加入5mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况.反应第10分钟达到平衡,从反应开始到平衡,用H2表示平均反应速率v(H2)=______。
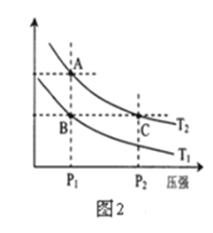
(2)图2表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A______C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A______C,由状态B到状态A,可采用______的方法(填“升温”或“降温”)。
(3)恒容条件下,下列措施中能使![]() 减小的有______
减小的有______
A.升高温度 B.充入He气 C.再充入2molCO和5molH2 D.使用催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】25°C时,0.1 mol/L的醋酸溶液中H+的浓度为a mol/L,0.01 mol/L的醋酸溶液中H+浓度为b mol/L,则a:b_______10。(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】做焰色反应实验时所用的铂丝,每次用毕后都要
A.用水多洗几次
B.先用稀盐酸洗,再用水洗
C.用稀盐酸洗,再在火焰上灼烧到没有什么颜色为止
D.放在火焰上灼烧,直到铂丝发红为止
查看答案和解析>>
科目: 来源: 题型:
【题目】已知2A(g)+B(g)![]() 2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后,C的浓度为ω mol·L-1,放出的热量为b kJ。
2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后,C的浓度为ω mol·L-1,放出的热量为b kJ。
(1)已知:A(g)+X(g)![]() 2B(g) ΔH=-133.2 kJ·mol-1;
2B(g) ΔH=-133.2 kJ·mol-1;
5A(g)+X(g)![]() 4C(g) ΔH=-650.4 kJ·mol-1。则a=________。
4C(g) ΔH=-650.4 kJ·mol-1。则a=________。
(2)不同温度下该反应的平衡常数如表所示。由此可推知,表中T1________T2(填“>”“=”或“<”)。
T/K | T1 | T2 | T3 |
K | 6.86 | 2.45 | 1.88 |
(3)若将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,放出的热量为d kJ,则d________b(填“>”“=”或“<”)。
(4)在一定温度下,向一个容积可变的恒压容器中,通入3 mol A和2 mol B,发生反应2A(g)+B(g)![]() 2C(g),平衡时容器内气体物质的量为起始时的80%。保持同一反应温度,在相同容器中,将起始投入量改为6 mol A、4 mol B,则平衡时A的体积分数为________。
2C(g),平衡时容器内气体物质的量为起始时的80%。保持同一反应温度,在相同容器中,将起始投入量改为6 mol A、4 mol B,则平衡时A的体积分数为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
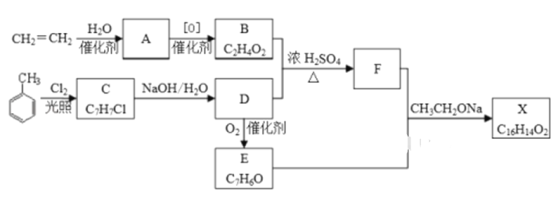
已知:RX![]() ROH;RCHO+CH3COOR′
ROH;RCHO+CH3COOR′![]() RCH=CHCOOR′
RCH=CHCOOR′
请回答:
(1)C 的结构简式________________ ,A中官能团的名称是__________
(2)B+D→F的化学方程式___________________________,其反应类型为_____________
(3)X的结构简式___________________
(4)D→E的化学方程式____________________________________
(5)F有多种同分异构体,符合下列条件的同分异构体数目有______种,请写出其中一种同分异构体的结构简式________
①是苯的二元取代物
②能发生水解及银镜反应
③核磁共振氢谱有5个吸收峰,峰面积之比为3:2:2:2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】“一碳化学”是指以含一个碳原子的化合物(如:CO2、CO、CH4、CH3OH等)为初始反应物,合成一系列重要的化工原料和燃料的化学。以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)![]() NH2COONH4(s) △H1=-159.47kJ/mol K1
NH2COONH4(s) △H1=-159.47kJ/mol K1
反应II:NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol K2
CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol K2
总反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H3 K3
CO(NH2)2(s)+H2O(g) △H3 K3
请回答:
(1)①总反应的△H3=_______kJ/mol。该热化学方程式的平衡常数K3=______(用K1、K2表示)。
②一定温度下,在体积固定的密闭容器中按计量比进行反应I,下列不能说明反应达平衡状态的是_____________。
A.混合气体的平均相对分子质量不再变化
B.容器内气体总压强不再变化
C.2V正(NH3)=V逆(CO2)
D.容器内混合气体的密度不再变化
③环境为真空时,在一敞开容器(非密闭容器)中加入NH2COONH4固体,足够长时间后,反应是否建立平衡状态? ___________(填“是”或“否”)。
(2)在体积可变的恒压 (P总) 密闭容器中充入1 mol CO2 与足量的碳,让其发生反应:C(s)+ CO2(g)![]() 2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。
2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。

①T℃时,达平衡后向容器中若充入稀有气体,v(正)___v(逆) (填“>”“<”或“=”);若充入等体积的CO2 和CO,平衡________移动(填“正向”“逆向”或“不”)。
②650℃,CO2 的转化率为_____________。
③已知:气体分压(P分)=气体总压×体积分数。用平衡分压代替平衡浓度表示平衡常数,925℃时,Kp=_____________ (用含P总的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com