
科目: 来源: 题型:
【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在_________(填编号字母)称量。
A、小烧杯中 B、洁净纸片上 C、托盘上
(2)滴定时,用0.2000 mol/L的盐酸标准液来滴定待测溶液,可选用_______(填编号字母)作指示剂。
A、甲基橙 B、石蕊 C、酚酞
(3)滴定过程中,眼睛应注视_______________________________,若用酚酞做指示剂,滴定终点的标志是_____________________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是________mol/L,烧碱样品的纯度是_____________。
滴定 次数 | 待测溶液 体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(5)若未用待测液润洗盛放标准盐酸的滴定管,则可使测定结果______(“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:
①2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
②2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
③H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
则下列说法正确的是
A. H2(g)的燃烧热为571.6 kJ·mol-1
B. ![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)===
Ba(OH)2(aq)===![]() BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
C. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
D. 2molH2(g)在足量氧气中完全燃烧生成气态水放出热量大于571.6kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】金属及其化合物在生产中用途广泛。
Ⅰ利用生产硼砂的废渣一一确镁泥(主要成分为MgCO3.SiO2,还含有少量Fe2O3、MnO、CaO等)为主要原料制取轻质碳酸镁[MgCO3:Mg(OH)2:2H2O]的工业流程如下:
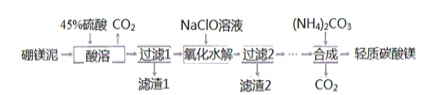
(1)写出“酸溶"一步中,MgCO3和硫酸反应的离子方程式________________________。
(2)滤渣2的主要成分有MnO2和____,写出生成MnO2的离子方程式_____________。
(3)“合成”时需通蒸汽至80℃,边加热边搅拌,温度不能超80℃的原因是________。
II.从含铜丰富的自然资源黄铜矿(CuFeS2)冶炼铜的工艺流程如下:
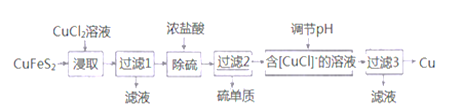
已知:①CuFeS2+3CuCl2=4CuCl↓+FeCl2+2S↓ ②+1价的Cu在酸性条件下易歧化
(4)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为_______________。
(5)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为__________。
(6)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是______。(填离子符号)
查看答案和解析>>
科目: 来源: 题型:
【题目】有下列物质的溶液 ①CH3COOH ②HCl ③H2SO4 ④NaHSO4
(1)若四种溶液的物质的量浓度相同,其c(H+)最大的是________(用序号表示,下同)。
(2)若四种溶液的c(H+)相同,其物质的量浓度最大的是________。
(3)将pH相同的上述四种溶液与Zn反应生成等量氢气,所需时间最短的是_________。
(4)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为________,经测定溶液中c(CH3COO-)为1.4×10-3 mol·L-1,此温度下醋酸的电离常数Ka=________,(写出计算式,不必计算最终结果)。温度升高,Ka将______(填“变大”、“不变”或“变小”)。
(5)在常温下将pH=11的NaOH溶液a L与pH=2的H2SO4溶液b L混合,若混合后溶液呈中性,则a:b=_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g) ![]() FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:
FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:

(1)0~8 min,v(CO2)=__________mol·L-1·min-1。
(2)该反应在恒温恒容的密闭容器中进行,能说明该反应达到化学平衡状态的是_____
A、单位时间内 ,每消耗1molCO2同时生成1molCO
B、容器内气体的压强不再随时间变化
C、容器内气体的密度不再随时间变化
D、容器内气体的平均相对分子质量不再随时间变化
(3)计算该温度下,反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g)的平衡常数__________
FeO(s)+CO(g)的平衡常数__________
(4)下列措施中,能够改变平衡时c(CO)/c(CO2)的比值的是________(填序号)。
A、温度 B、铁粉的量(足量) C、压强 D、CO的量
(5)已知:反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g) ![]() FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
温度/K | K1 | K2 |
973 | 1.47 | 2.38 |
1 173 | 2.15 | 1.67 |
①反应Fe(s)+H2O(g) ![]() FeO(s)+H2(g)为______(填“吸热”或“放热”)反应
FeO(s)+H2(g)为______(填“吸热”或“放热”)反应
②根据表中数据,计算反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) 973 K的K______(写出计算式即可,不必计算结果)。
CO(g)+H2O(g) 973 K的K______(写出计算式即可,不必计算结果)。
查看答案和解析>>
科目: 来源: 题型:
【题目】请从下图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性。

(1)A极发生的电极反应式是___________ ,B极发生的电极反应式是_____________。
(2)设计上述气体实验装置时,各接口的正确连接顺序为:
A接_____、 ____接______;B接______、_____接______ 。
(3)在实验中,盛有KI淀粉溶液的容器中发生反应的离子方程式为_________________。
(4)已知饱和食盐水50mL(假设NaCl足量且忽略溶液体积变化),某时刻测得H2体积为16.8 mL(标准状况)。此时溶液OH- 浓度为___________。
(5)已知甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将甲烷燃料电池作为电源,进行上述饱和食盐水电解实验。若甲烷通入量为2.24L(标准状况),且反应完全,则理论上电解池产生的为Cl2 的物质的量为______
查看答案和解析>>
科目: 来源: 题型:
【题目】元素X的原子核外M层上有3个电子,元素Y形成的离子Y2-核外有18个电子,则这两种元素可形成化合物( )
A.XY2B.X2Y3C.X3Y2D.X2Y
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于苯的叙述正确的是

A. 反应①为取代反应,有机产物的密度比水小
B. 反应②为氧化反应,反应现象是火焰明亮并带有较多的黑烟
C. 反应③为取代反应,反应时可以直接用酒精灯加热,有机产物是一种烃
D. 反应④1molC6H6能与3molH2发生加成反应,是因为苯分子含有三个碳碳双键
查看答案和解析>>
科目: 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其pH与溶液体积V的关系如图所示。

下列说法正确的是( )
A. A、B两酸溶液的物质的量浓度一定相等
B. 稀释后,A酸溶液的酸性比B酸溶液强
C. a=5时,A是强酸,B是弱酸
D. 若A、B都是弱酸,则5≥a>2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com