
科目: 来源: 题型:
【题目】“84”消毒液在日常生活中使用广泛,该消毒液无色,有漂白作用.它的有效成分是下列物质中的一种,这种物质是:
A.Na2O2B.NaOHC.KMnO4D.NaClO
查看答案和解析>>
科目: 来源: 题型:
【题目】不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是

A. Fe2+的氧化率随时间延长而逐渐增大
B. 由②和③可知,pH越大,Fe2+氧化速率越快
C. 由①和③可知,温度越高,Fe2+氧化速率越快
D. 氧化过程的离子方程式为:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。

(1)用离子方程式表示Na2CrO4溶液中的转化反应____________。
(2)由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大“减小”或“不变”),溶液中c(Cr2O72-)与c(CrO42-)的比值将_____________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为________________ (水的浓度不计入平衡常数表达式)。
(3)升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH_________0(填“大于”“小于”或“等于”)。
(4)向K2Cr2O7溶液中加入AgNO3溶液,发生离子互换反应,生成砖红色沉淀且溶液的pH下降,生成的砖红色沉淀的化学式为_______________。
(5)+6价铬的化合物毒性较大,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,反应的离子方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钙(CaO2)常用作种子及谷物的无毒性消毒剂,常温下为白色的固体,微溶于水,且不溶于乙醇、乙醚和碱性溶液,但溶于酸。
某实验小组拟探究CaO2的性质及其实验室制法。
(1)实验探究CaO2与酸的反应。
操作 | 现象 |
向盛有4 g CaO2的大试管中加入10mL稀盐酸得溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
取5 mL溶液a于试管中,滴入两滴石蕊试液 | 溶液变红,一段时间后溶液颜色明显变浅,稍后,溶液变为无色 |
①CaO2与盐酸反应的化学方程式为_______________________________。
②加入石蕊试液后溶液褪色可能是因为溶液a中存在较多的_________。
(2)用如图所示装置制备过氧化钙,其反应原理为Ca+O2![]() CaO2。
CaO2。
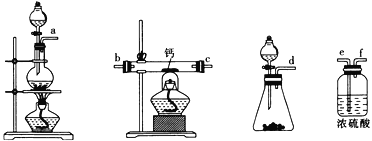
①请选择实验所需要的装置,按气流方向连接的顺序为______________________(填仪器接口的字母,上述装置可不选用也可重复使用)。
②根据完整的实验装置进行实验,实验步骤如下:Ⅰ.检验装置的气密性后,装入药品;Ⅱ.打开分液漏斗活塞,通入气体一段时间,加热药品;Ⅲ.反应结束后,_________________________________(填操作);Ⅳ.拆除装置,取出产物。
(3)利用反应:Ca2++ H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4+在碱性环境下制取CaO2的装置如图所示。

①NH3在Ca2+和H2O2的反应过程中所起的作用是______________________。
②反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。过滤需要的玻璃仪器是_________;将沉淀进行洗涤的操作为_____________________________________________。
(4)设计实验证明CaO2的氧化性比FeCl3的氧化性强:____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氧燃料电池已用于航天飞机,其工作原理如图所示。关于该燃料电池的说法不正确的是
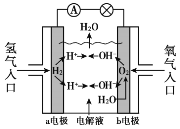
A. H2在负极发生氧化反应
B. 电子从a电极经外电路流向b电极
C. 供电时的总反应为:2H2 + O2 == 2H2O
D. 燃料电池的能量转化率可达100%
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨工业在国民生产中有重要意义。回答下列问题:
(1)在恒温恒压条件下,在装置中发生合成氨的反应N2(g)+3H2(g)![]() 2NH3(g) ,下列说法正确的是(______)(填字母)
2NH3(g) ,下列说法正确的是(______)(填字母)
A.气体体积不再变化,则已经平衡
B.气体密度不再变化,可能尚未达到平衡
C.平衡后,向装置中通入氩气,压强不变,平衡不移动
D.平衡后,压缩体积,则生成更多的氨气
E.催化剂可以提高生产氨气的产率
(2)N2(g)+3H2(g)![]() 2NH3(g) ΔH = —92.0 kJ·mol-1,恒容时,体系中各物质浓度随时间变化曲线如图1所示。
2NH3(g) ΔH = —92.0 kJ·mol-1,恒容时,体系中各物质浓度随时间变化曲线如图1所示。
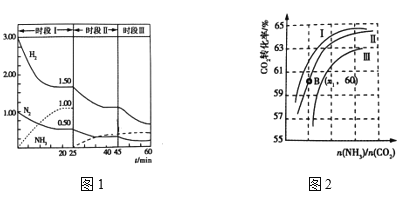
①25min时采取的措施是 _______________________________ 。
②三个时间段分别是改变一个条件引起的平衡移动,平衡时平衡常数KⅠ、KⅡ、KⅢ的大小关系 __________________。
③在实际工业生产中和①中措施的目的相同的其他措施还有 _____________________(写两条)
(3)①合成氨工艺生产中间环节产生的CO会导致催化剂中毒,常用铜液[醋酸二氨合铜(Ⅰ)、氨水]吸收,Cu(NH3)2Ac + CO + NH3 ![]() [Cu(NH3)3CO]Ac ΔH<0。简述吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)__________________________________________________________________________
[Cu(NH3)3CO]Ac ΔH<0。简述吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)__________________________________________________________________________
②如果要提高上述反应的反应速率,且提高氨气的转化率,可采取的措施有(______)
a. 加压 b.加催化剂 c.升温 d.及时移走产物
(4)①用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g) ΔH<0。已知该反应的v (正)=k(正)c2(NH3)c(CO2),v (逆)=k(逆)c(H2O),k(正)和k(逆)为速率常数,则平衡常数K与k(正)、k(逆)的关系式是__________________
CO(NH2)2(l)+H2O(g) ΔH<0。已知该反应的v (正)=k(正)c2(NH3)c(CO2),v (逆)=k(逆)c(H2O),k(正)和k(逆)为速率常数,则平衡常数K与k(正)、k(逆)的关系式是__________________
②实际生产中,原料气带有水蒸气,图2表示CO2转化率与氨碳比![]() 、水碳比
、水碳比![]() 的变化关系。
的变化关系。
a. 曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比![]() 最大的是_______________。
最大的是_______________。
b.测得B点氨的转化率为40%,则X1= _________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】硼化钒(VB2)-空气电池是目前储电能力最高的电池,示意图如图所示,该电池工作时的反应为4VB2+11O2=4B2O3+2V2O5。下列说法错误的是
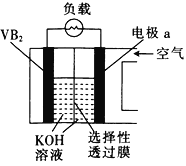
A. 电极a的电势比VB2极的高
B. VB2极的电极反应式为2VB2-22e-+22OH-=2B2O3+V2O5+11H2O
C. 放电时,OH-由VB2极向a电极移动
D. 若采用稀盐酸作电解质溶液,则该电池发生的总反应改变
查看答案和解析>>
科目: 来源: 题型:
【题目】某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号 | T/K | 大理石规格 | HNO3浓度/mol·L-1 | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格(粗、细)对该反应速率的影响; |
② | _____ | _____ | _____ | |
③ | _____ | _____ | _____ | |
④ | _____ | _____ | _____ |
(2)实验装置如图1所示,如何检验该装置的气密性________________________________

(3)实验①中CO2质量随时间变化的关系见下图2:依据反应方程式CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O,计算实验①在70-90 s范围内HNO3的平均反应速率________________________
(4)请在答题卡的框图中,画出实验②、③和④中CO2质量随时间变化关系的预期结果示意图。_______
查看答案和解析>>
科目: 来源: 题型:
【题目】对温室气体CO2进行减排和综合治理具有重要意义。回答下列问题:
Ⅰ. O2辅助的Al~CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。

(1)电池的负极反应式:______________________________________________ 。电池的正极反应式:6O2+6e![]() 6O2 ;6CO2+6O2
6O2 ;6CO2+6O2![]() 3C2O42 + 6O2
3C2O42 + 6O2
(2)反应过程中O2的作用是________。
(3)该电池的总反应式:_________________________________。
Ⅱ. CH4-CO2催化重整不仅对温室气体的减排具有重要意义,还可以得到合成气(CO和H2)。
已知:①CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1 =+206.2 kJ/mol K1
②CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH2 = +165.0 kJ/mol K2
(4)写出该催化重整反应的热化学方程式__________________________________________。
K=_________(用 K1 、K2表示)
(5)恒温恒压下,向容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,此时体积为2 L,一段时间后达到平衡时,CO2的转化率是50%,其平衡常数为_______。
(6)分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体让其发生催化重整反应。两容器中反应达平衡后放出或吸收的热量较多的是_______(填“A” 或“B ”)。
(7)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:
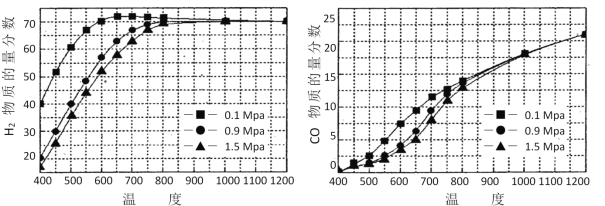
若要达到H2物质的量分数>65%、CO的物质的量分数<10%,以下条件中最合适的是___。
A.600℃,0.9Mpa B.700℃,0.9MPa C.800℃,1.5Mpa D.1000℃,1.5MPa
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白。
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________,直到因加入一滴盐酸后,溶液由________色变为________色,并________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是__________。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)某学生根据3次实验分别记录有关数据如下表:
滴定 次数 | 待测NaOH 溶液的体积/mL | 0.100 0 mol·L-1 盐酸的体积/mL | ||
滴定前读数 | 滴定后读数 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据计算该NaOH溶液的物质的量浓度___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com