
科目: 来源: 题型:
【题目】在373K时,把0.5mol N2O4气体通入体积为5L的恒容密闭容器中,立即出现红棕色。反应进行到2秒时,NO2的浓度为0.02 mol/L。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A. 前2秒,以N2O4的浓度变化表示的平均反应速率为0.01mol/(L·s)
B. 在2秒时体系内的压强为开始时的1.2倍
C. 在平衡时体系内含N2O40.20mol
D. 平衡时,如果再充入一定量N2O4, 则可提高N2O4的转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示),下列说法错误的是
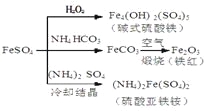
A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 常温下,(NH4)2Fe(SO4)2比FeSO4易溶于水
查看答案和解析>>
科目: 来源: 题型:
【题目】已知氨水的浓度越大,密度越小。将质量分数为W %的氨水和质量分数为5W %的氨水等体积混合,所得溶液中氨的质量分数为
A.6W %B.3W %C.大于3W %D.小于3W %
查看答案和解析>>
科目: 来源: 题型:
【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组对氯水成分和性质进行研究,实验如下:

(1)氯水呈黄绿色,说明其中含有_________(填化学式)。
(2)实验一的现象表明,氯水具有酸性和_________性。
(3)氯气与水反应的化学方程式为__________。
(4)用化学用语说明实验二中“红色不褪去”的原因_______。
(5)实验四证明了实验三中“红色不褪去”不是因为氯水被稀释所致,补充所加试剂和现象。
(实验四)
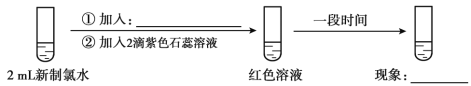
①加入:____________,现象:___________;
(6)进一步探究实验三中“红色不褪去”的原因。
(实验五)取实验三的白色沉淀,洗涤,用饱和氯化钠溶液浸泡,取上层清液,滴加2滴紫色石蕊溶液,一段时间后,颜色褪去。写出氯水和硝酸银溶液反应的化学方程式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于平衡体系mA(g)+nB(g)![]() pC(g)+qD(g) ΔH<0。下列结论中错误( )
pC(g)+qD(g) ΔH<0。下列结论中错误( )
A. 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B. 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C. 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D. 若A为固体,则增大压强,平衡向逆向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温恒压下,向密闭容器中充入4mol A和2 mol B,发生如下反应:2A(g)+B(g)![]() 2C(g)ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是()
2C(g)ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是()
A. 若反应开始时容器体积为2L,则Vc=0.4molL-1min-1
B. 若在恒压绝热条件下反应,平衡后nc<1.6mol
C. 若2min后,向容器中再投入2mol A和1 mol B, B的转化率变大
D. 若该反应在恒温恒容下进行,放出热量将增加
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效氧化、杀菌及漂白剂,其生产工艺如下:

(1)NaClO2中氯元素的化合价是_________。从氧化还原角度推测NaClO2可能具有的化学性质是_________。
(2)过程I常伴有少量Cl2生成。
① Cl2的存在会造成产品中含有NaCl,请结合离子方程式解释其原因_________。
② 结合下面信息,请设计实验方案除去ClO2中的Cl2 ________。
ClO2 | Cl2 | |
在水中的溶解性 | 易溶 | 溶 |
在CCl4中的溶解性 | 难溶 | 溶 |
(3)过程II中H2O2的作用是________(填“氧化剂”或“还原剂”)。
(4)理论上每生成1 mol NaClO2,消耗SO2的体积是________L(标准状况下)。
(5)已知:
i. 压强越大,物质的沸点越高。
ii. NaClO2饱和溶液在温度低于38℃时析出NaClO23H2O
38~60℃时析出NaClO2晶体
高于60℃时分解成NaClO3和NaCl
① 过程III采用“减压蒸发”操作的原因是_____。
② 请将过程III的操作补充完整_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年是元素周期表诞生150周年,元素周期表(律)在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
族 周期 | IA | 0 | ||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ||||||||
(1)元素①~⑧中,金属性最强的是________(填元素符号)。
(2)中国青年化学家姜雪峰被国际组织推选为“元素⑦代言人”,元素⑦的原子结构示意图是________,其氢化物的电子式是_________。
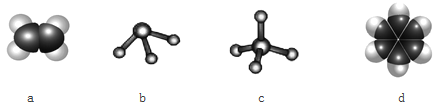
(3)元素①和②可以形成多种化合物。下图模型表示的分子中,不可能由①和②形成的是_______(填序号)。
(4)比较元素②、③的最高价氧化物对应水化物的酸性:______>______(填化学式)。说明你判断的理由:_________。
(5)主族元素砷(As)的部分信息如图所示。
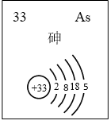
i.砷(As)在周期表中的位置是______。
ii.下列说法正确的是_______(填序号)。
a. 砷元素的最高化合价为+4
b. 推测砷有多种氧化物
c. ③的气态氢化物的还原性大于砷的气态氢化物的还原性
(6)某小组同学设计实验比较VIIA元素的非金属性:Cl>Br>I。
已知:常温下浓盐酸与高锰酸钾反应生成氯气。
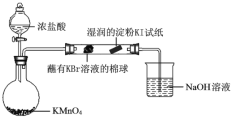
打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙红色,湿润的淀粉KI试纸变蓝,据此现象能否说明非金属性:Br > I,并说明理由_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com