
科目: 来源: 题型:
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经150年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为___;
(2)元素①的单质电子式为____。
(3)比较③、⑤元素的金属性强弱___>___;并写出它们最高价氧化物对应的水化物间反应的化学方程式____。
(4)上述元素的最高价氧化物对应的水化物中,酸性最强的是____。
(5)在元素③、④、⑤、⑦、⑧形成的简单离子中,半径最小的是_____;
(6)工业制取⑥的单质的反应的化学方程式为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于铁及其化合物的叙述正确的是
A.铁粉在Cl2中燃烧生成FeCl2B.铁单质只有还原性,其阳离子只有氧化性
C.Fe(OH)3可经化合反应一步得到D.因为Fe的活泼性大于Cu,故Cu与FeCl3不反应
查看答案和解析>>
科目: 来源: 题型:
【题目】NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe等杂质)为原料获得。有关工艺流程如下:

注:(1)NiCO3是一种不溶于水、易溶于强酸的浅绿色沉淀。
(2)25℃,Ksp[Fe(OH)3]=2.64×10-39;溶液中离子浓度小于10-5mol·L-1,可视为沉淀完全。
请回答下列问题:
(1)用稀硫酸溶解废渣时,为了提高浸取率可采取的措施有_________________。(任写一点)
(2)在滤液Ⅱ中加入H2O2时,温度不能太高的原因是______________________。
(3)滤液Ⅲ中溶质的主要成分是__________________ ,检验滤液Ⅲ中是否还有铁元素的方法是_______________________。
(4)除铁时还常用NaClO3作氧化剂,在较小的pH条件下最终生成一种浅黄色的黄铁矾钠 [Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度-pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域。下列说法正确的是__________________(选填序号)。

a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10-27mol·L-1
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中常保持在85~95℃生成黄铁矾钠,此时水体的pH为1.5左右
(5)从“沉淀A”制得NiSO4·6H2O晶体的实验步骤依次为:_________________,用少量乙醇洗涤NiSO4·6H2O晶体并晾干。(实验中须使用的试剂有:6mol·L-1的H2SO4溶液,蒸馏水)
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,二氧化氮和四氧化二氮之间存在下列平衡2NO2(g)![]() N2O4(g)(放热反应)在测定NO2的相对分子质量时,下列条件中,测定结果误差最小的是( )
N2O4(g)(放热反应)在测定NO2的相对分子质量时,下列条件中,测定结果误差最小的是( )
A. 温度130℃,压强3.03×105PaB. 温度25℃,压强1.01×105Pa
C. 温度130℃,压强5.05×104PaD. 温度0℃,压强5.05×104Pa
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色的气体,易溶于水,是目前国际上公认的第四代高效、无毒的消毒剂。
(1)目前,氯化钠电解法是一种可靠的工业生产ClO2的方法(如图所示)。
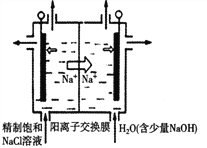
用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,写出阳极产生ClO2的电极反应式___________________。
(2)将ClO2用水吸收得到溶液,为了测定该溶液的浓度,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.0mL试样,取其中10.00mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤20,加入足量的KI晶体,充分反应;
步骤3:加入淀粉溶液作指示剂,用0.2mol·L-1Na2S2O3标准溶液滴定至终点,再重复2次,测得消耗Na2S2O3溶液的平均值为20.00mL。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①若步骤2所得溶液放置时间太长,则测定结果会__________。(填“偏高”、“偏低”或“不变”)
②步骤3中,滴定终点的现象是__________________ 。
③通过计算确定原ClO2溶液的物质的量浓度。(写出计算过程)_______________________
查看答案和解析>>
科目: 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
①CH3OH(g)+3/2O2(g)![]() CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
②CO(g)+1/2O2(g)![]() CO2(g) ΔH=-283.0 kJ·mol-1
CO2(g) ΔH=-283.0 kJ·mol-1
③H2(g)+1/2O2(g)![]() H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2 (g)![]() CH3OH(g) ΔH=________ kJ·mol-1。
CH3OH(g) ΔH=________ kJ·mol-1。
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号)。
a. 使用高效催化剂 b. 降低反应温度
c. 增大体系压强 d. 不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。
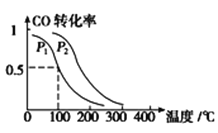
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=_______;
③100℃时,达到平衡后,保持压强P1不变的情况下,再向容器中通入CO、H2和CH3OH各0.5a mol,则平衡_______ (填“向右”、“向左”或“不”移动)。
④在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
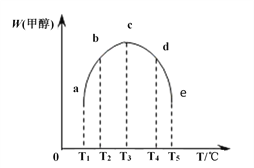
(4)在容积均为1L的密闭容器(a、b、c、d、e)中,分别充入1molCO和2molH2等量混合气体,在不同的温度下(温度分别为T1、T2、T3、T4、T5),经相同的时间,在t时刻,测得容器甲醇的体积分数如图所示。在T1- T2及T4- T5两个温度区间,容器内甲醇的体积分数的变化趋势如图所示,其原因是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:P4(g)+6Cl2(g) ![]() 4PCl3(g) ΔH=a kJ·mol-1,P4(g)+10Cl2(g)
4PCl3(g) ΔH=a kJ·mol-1,P4(g)+10Cl2(g) ![]() 4PCl5(g) ΔH=b kJ·mol-1,P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ·mol-1,PCl3中P—Cl键的键能为 1.2c kJ·mol-1。
4PCl5(g) ΔH=b kJ·mol-1,P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ·mol-1,PCl3中P—Cl键的键能为 1.2c kJ·mol-1。
下列叙述正确的是
A. PCl3比PCl5稳定
B. 可求Cl2(g)+PCl3(g) ![]() PCl5(s)的反应热ΔH
PCl5(s)的反应热ΔH
C. Cl—Cl键的键能为(b -a+5.6c)/4 kJ·mol-1
D. P—P键的键能为(5a-3b+12c)/8 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】将一小块钠投入盛10mL饱和澄清石灰水的烧杯中,不可能观察到的现象是
A. 钠熔成小球并在液面上游动 B. 有气体生成
C. 溶液底部有银白色金属物质生成 D. 溶液变浑浊
查看答案和解析>>
科目: 来源: 题型:
【题目】以下广告语中,符合科学道理的是( )
A.“超纯净水”绝对卫生,对人有益
B.含碘食盐可以防治甲状腺肿大
C.无糖饼干中不含糖类物质
D.本饮料由纯天然物质配成,绝对不含化学物质,对人无害
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com