
科目: 来源: 题型:
【题目】有关蛋白质的叙述中不正确的是( )
A.向蛋白质溶液滴加硫酸铜溶液发生盐析
B.蛋白质遇浓硝酸显黄色
C.蛋白质溶液具有丁达尔效应
D.蛋白质的基本结构单元是氨基酸
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于苯的叙述正确的是
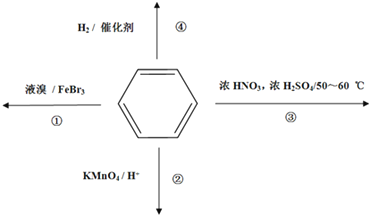
A. 反应①常温下能进行,其有机产物为![]()
B. 反应②不发生,但是仍有分层现象,紫色层在下层
C. 反应③为加成反应,产物是三硝基甲苯
D. 反应 ④中1mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键
查看答案和解析>>
科目: 来源: 题型:
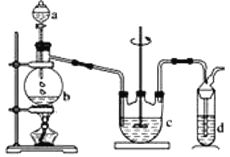
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性溶液中分解产生S、SO2。
Ⅰ.Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2制得,实验室模拟该工业过程的装置如图所示。
(1)b中反应的离子方程式为____,c中试剂为_____。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是_____。
(3)实验中要控制SO2生成速率,可以采取的措施有______(写出两条)。
(4)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是____。
(5)制备得到的Na2S2O3中可能含有Na2SO3、Na2SO4等杂质。设计实验,检测产品中是否存在Na2SO4:_____。
Ⅱ.探究Na2S2O3与金属阳离子的氧化还原反应。
资料:ⅰ.Fe3++3S2O32-![]() Fe(S2O3)33-(紫黑色)
Fe(S2O3)33-(紫黑色)
ⅱ.Ag2S2O3为白色沉淀,Ag2S2O3可溶于过量的S2O32-
装置 | 编号 | 试剂X | 实验现象 |
| ① | Fe(NO3)3溶液 | 混合后溶液先变成紫黑色, 30s后溶液几乎变为无色 |
② | AgNO3溶液 | 先生成白色絮状沉淀,振荡后,沉淀溶解,得到无色溶液 |
(6)根据实验①的现象,初步判断最终Fe3+被S2O32-还原为Fe2+。从化学反应速率和平衡的角度解释实验Ⅰ的现象:_____。
(7)同浓度氧化性:Ag+ > Fe3+。实验②中Ag+未发生氧化还原反应的原因是____。
(8)进一步探究Ag+和S2O32-反应。
装置 | 编号 | 试剂X | 实验现象 |
| ③ | AgNO3溶液 | 先生成白色絮状沉淀,沉淀很快变为黄色、棕色,最后为黑色沉淀。 |
实验③中白色絮状沉淀最后变为黑色沉淀(Ag2S)的化学方程式如下,填入合适的物质和系数:Ag2S2O3+___=Ag2S+___
(9)根据以上实验,Na2S2O3与金属阳离子发生氧化还原反应和___有关(写出两条)。
查看答案和解析>>
科目: 来源: 题型:
【题目】质子核磁共振谱(PMR)是研究有机物结构的重要方法之一。在研究的化合物分子中:所处环境完全相同的氢原子在PMR谱中出现同一种信号峰:如(CH3)2CHCH2CH3在PMR谱中有四种信号峰。又如CH3-CHBr=CHX存在着如下的两种不同空间结构:
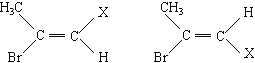
因此CH3-CHBr=CHX的PMR谱上会出现氢原子的四种不同信号峰。
请填写下列空白:
(1)化学式为C3H6O2的物质在PMR谱上观察到下列两种情况下氢原子给出的信号峰:第一种情况出现两个信号峰,第二种情况出现三个信号峰,由此可推断对应于这两种情况该有机物质结构式可能为:____________________、____________________;
(2)测定CH3CH=CHCl时:能得到氢原子给出的信号峰6种:由此可推断该有机物一定存在______种不同的结构:其结构式为:_________________、_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按如图装置进行实验,下列推断正确的是( )
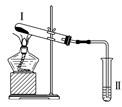
选项 | Ⅰ中试剂 | Ⅱ中试剂及现象 | 推断 |
A | 氯化铵 | 酚酞溶液不变红色 | 氯化铵稳定 |
B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成FeO和SO2 |
C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液褪色 | 石蜡油发生了化学变化 |
D | 铁粉与水蒸气 | 肥皂水冒泡 | 铁粉与水蒸气发生了反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列说法正确的是( )
A. 用惰性电极电解NaH2PO2溶液,其阳极反应式为2H2O+4e-=O2↑+4H+
B. 将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的还原产物可能为H3PO4
C. H3PO2与过量NaOH溶液反应的离子方程式为H3PO2+3OH-= PO23-+3H2O
D. H3PO2溶于水的电离方程式为H3PO2![]() H++H2PO2-
H++H2PO2-
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上可利用“甲烷蒸气转化法”生产氢气,反应的热化学方程式为CH4(g)+H2O(g)CO2(g)+3H2(g) △H=+161.1kJ·mol-1
(1)已知温度、压强对甲烷平衡时的体积分数的影响如图1,请回答:
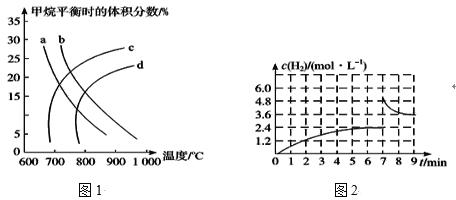
①图1中a、b、c、d四条曲线中的两条代表压强分别为1MPa、2MPa时甲烷体积分数的曲线,其中表示1MPa的是_____。
②该反应的平衡常数:K(600℃)___(填“>”“<”或“=”)K(700℃)。
(2)①已知:在700℃、1MPa时,1molCH4与1molH2O在1L的密闭容器中反应,6min时达到平衡(如图2),此时CH4的转化率为__,该温度下反应的平衡常数为____(结果保留小数点后一位数字)。
②从图2分析,由第一次平衡到第二次平衡,平衡移动的方向是____(填“向正反应方向”或“向逆反应方向”)移动,采取的措施可能是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com