
科目: 来源: 题型:
【题目】氮和碳的化合物与人类生产、生活密切相关。
(1)已知:N2(g)+O2(g)===2NO(g); ΔH=+180.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g); ΔH=-483.6 kJ·mol-1
则反应2H2(g)+2NO(g)===2H2O(g)+N2(g);ΔH=__________。
(2)在压强为0.1 MPa条件,将CO和H2的混合气体在催化剂作用下转化为甲醇的反应为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
①下列能说明该反应达到平衡状态的是________________。
a.混合气体的密度不再变化 b.CO和H2的物质的量之比不再变化
c.v(CO)=v(CH3OH) d.CO在混合气中的质量分数保持不变
②T1℃时,在一个体积为5 L的恒压容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.75,则T1℃时,CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=_______________________。
CH3OH(g)的平衡常数K=_______________________。

③在T1℃时,在体积为5 L的恒容容器中充入一定量的H2和CO,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图所示。温度不变,当![]() 时,达到平衡状态,CH3OH的体积分数可能是图象中的___________点。
时,达到平衡状态,CH3OH的体积分数可能是图象中的___________点。
(3)用催化转化装置净化汽车尾气,装置中涉及的反应之一为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
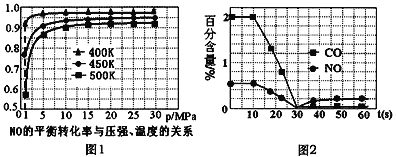
①探究上述反应中NO的平衡转化率与压强、温度的关系,得到如图1所示的曲线。催化装置比较适合的温度和压强是___________。
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图2所示。则前10 s内,CO和NO百分含量没明显变化的原因是____________。
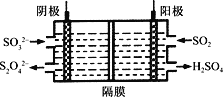
(4)如图所示的装置能吸收和转化NO2和SO2。
①阳极区的电极反应式为___________________________。
②阴极排出的溶液中含S2O![]() 离子,能将NO2气体转化为无污染气体,同时生成的SO
离子,能将NO2气体转化为无污染气体,同时生成的SO![]() 可在阴极区再生。写出该反应的离子方程式:___________________________。
可在阴极区再生。写出该反应的离子方程式:___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
(1)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu═2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为____________,当线路中转移0.2mol电子时,则被腐蚀铜的质量为______________ g.
(2)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为____________________.
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片
(3)燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:
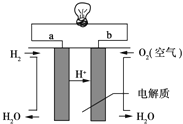
①氢氧燃料电池的总反应化学方程式是:__________________.
②电池工作一段时间后硫酸溶液的浓度___________(填“增大”、“减小”或“不变”).
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中含有SO42-、SO32-、HCO3-、CO32-等四种离子。将过量的Na2O2固体加入其中后,仍能大量存在的离子是( )
A.SO42-、HCO3-B.SO42-、SO32-、CO32-
C.SO32-、HCO3-D.SO42-、CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将0.10 mol·L-1盐酸逐滴滴入20.00 mL 0.10 mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH= -lg c(OH-)。下列说法正确的是( )
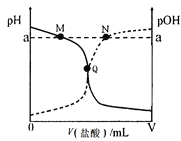
A. M点所示溶液中:c(NH4+)+c(NH3·H2O)= c(Cl-)
B. N点所示溶液中:c(NH4+)>c(Cl-)
C. Q点所示消耗盐酸的体积等于氨水的体积
D. M点和N点所示溶液中水的离子积相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关化学反应的叙述正确的是
A.室温下Na与空气中O2反应制取Na2O2B.Fe在稀硝酸中发生钝化
C.SO2与过量氨水反应生成(NH4)2SO3D.MnO2和稀盐酸反应制取Cl2
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与社会可持续发展密切相关。下列做法错误的是
A.利用风力发电,减少CO2的排放
B.为提高粮食产量,大量使用高残留农药
C.对秸秆进行加工,使其转化为汽车燃料
D.按照国家规定,对生活垃圾进行分类放置
查看答案和解析>>
科目: 来源: 题型:
【题目】已知乙醇的分子结构如图:其中 ①②③④⑤表示化学键代号,用代号回答:
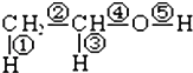
(1)乙醇与钠反应断裂的键是_______;
(2)乙醇与浓硫酸共热到170℃制乙烯,断裂的键是_______;
(3)乙醇与氧气在铜或银作催化剂,加热条件下反应断裂的键是_________;
(4)乙醇与乙酸在浓硫酸作用下反应断___________键.
查看答案和解析>>
科目: 来源: 题型:
【题目】苯甲酸钠(![]() ,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A–。已知25 ℃时,HA的Ka=6.25×10–5,H2CO3的Ka1=4.17×10–7,Ka2=4.90×10–11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25 ℃,不考虑饮料中其他成分)( )
,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A–。已知25 ℃时,HA的Ka=6.25×10–5,H2CO3的Ka1=4.17×10–7,Ka2=4.90×10–11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25 ℃,不考虑饮料中其他成分)( )
A. 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
B. 当pH为5.0时,饮料中c(HA) /c(A–)=0.16
C. 提高CO2充气压力,饮料中c(A–)不变
D. 碳酸饮料中各种粒子的浓度关系为:c(H+)=c(HCO3-)+c(CO32-)+c(OH–)–c(HA)
查看答案和解析>>
科目: 来源: 题型:
【题目】在100mL HNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6 mol L-1。向该溶液中加入足量的铜粉,加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为( )(反应前后溶液体积变化忽略不计)
A. 0.225 mol L-1 B. 0.30 mol L-1 C. 0.36 mol L-1 D. 0.45 mol L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com