
科目: 来源: 题型:
【题目】在一定体积的Ba(OH)2溶液中,OH-的物质的量浓度为0.01mol/L。向其中逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液中OH-的物质的量浓度为0.001mol/L。
(1)该Ba(OH)2溶液中Ba(OH)2的物质的量浓度为__________________。
(2)Ba2+恰好完全沉淀时,发生反应的离子方程式为_______________________。
(3)若反应后溶液的体积等于Ba(OH)2和NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是__________。
(4)如向NaHSO4溶液中逐渐加入Ba(OH)2溶液至中性,则发生反应的离子方程式为__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】R、X、Y、Z是短周期元素,原子序数依次增大。R是自然界中组成物质种类最多的元素,R原子最外层电子数是X原子最外层电子数2倍。Z的最高价氧化物对应的水化物(M)是强电解质,向含Y元素的钠盐溶液中滴加M溶液,产生沉淀的物质的量与M的物质的量关系如图所示。下列推断正确的是

A. R的氢化物可能使溴水或酸性高锰酸钾溶液褪色
B. Y的气态氢化物热稳定性比R的强
C. 常温常压下,Z的单质一定呈黄绿色
D. X和Z组成的化合物属于共价化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】将少量氯水加入KI溶液中,充分反应后,再加入苯,振荡,静置后观察到的现象是
A. 液体呈黄色,不分层 B. 有紫黑色固体析出
C. 液体分层,上层呈紫红色 D. 液体分层,下层呈紫红色
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组以 H2O2 分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2 溶液 | 无 |
② | 10 mL 5% H2O2 溶液 | 无 |
③ | 10 mL 5% H2O2 溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
④ | 10 mL 5% H2O2 溶液+少量 HCl 溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
⑤ | 10 mL 5% H2O2 溶液+少量 NaOH溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
(1)催化剂能加快化学反应速率的原因是_____。
(2)实验①和②的目的是_________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下 H2O2 稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_____。
(3)写出实验③的化学反应方程式:_____。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是_____。
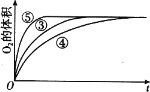
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,容积为2 L的密闭容器中,将2 mol L气体和3 mol M气体混合,发生如下反应:2L(g)+3M(g)![]() xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
(1)10 s末L的物质的量浓度为_____________。
(2)前10 s内用M表示的化学反应速率为_____________。
(3)化学方程式中x值为_____________。
(4)在恒温恒容条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
(5)在恒温恒压条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
查看答案和解析>>
科目: 来源: 题型:
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示,活化氧可以快速氧化二氧化硫。下列说法错误的是
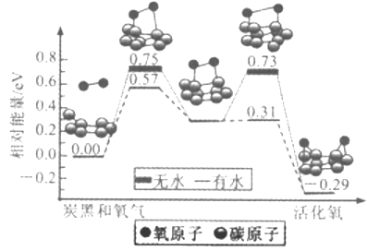
A. 氧分子的活化包括O-O键的断裂与C-O键的生成
B. 每活化一个氧分子放出0.29eV的能量
C. 水可使氧分子活化反应的活化能降低0.42eV
D. 炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D均为中学化学常见的纯净物,A是单质,它们有如图反应关系。下列说法错误的是( )

A.若A是大气中含量最多的气体,C、D是氧化物且会造成光化学污染。则D转化成C的反应化学方程为3NO2+H2O=2HNO3+2NO
B.若A、B、C分别为C(s)、CO(g)和CO2(g),且通过与O2(g)反应实现图示的转化。在同温同压且消耗含碳物质均为1mol时,反应①、②、③的焓变依次为△H 1、△H 2、△H 3,则它们之间的关系为 △H 2=△H 1+△H 3
C.若C为一元强碱且阴、阳离子所含的电子数相同,D为日常生活中常用的调味品,工业上用D制备A的化学方程式2Na2O(熔融)![]() 4Na+O2↑
4Na+O2↑
D.若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种气态非金属单质实验室保存D溶液的方法是加入适量铁粉与适量盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】2018年11月在法国凡尔赛召开的国际计量大会( General Conference on Weights and Measures,CGPM)第26次会议将阿伏加德罗常数的定义修改为“1摩尔包含6.02214076×1023个基本单元,这常数被称为阿伏加德罗常数,单位为mol-1”。基于这一新定义,阿伏加德罗常数的不确定度被消除了。新定义将于2019年5月20日正式生效。NA为阿伏加德罗常数的值。下列说法错误的是
A. 22.4L(标准状况)氖气含有的电子数为10NA
B. 0.4 moI NH3与0.6mo1O2在催化剂的作用下充分反应,得到NO的分子数为0.4NA
C. 27g铝中加入足量1mol·L-1的NaOH溶液,转移的电子数为3NA
D. 常温常压下,水蒸气通过Na2O2使其增重2g时,反应中转移的电子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】为了探究铁铜及其化合物的性质,某同学设计并进行了下列实验。下列说法错误的是
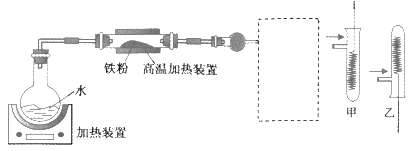
A. 高温加热装置中发生的反应为3Fe(s)+4H2O(g) ![]() Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)
B. 虚线框处宜选择的装置是甲
C. 实验时将螺旋状铜丝加热变黑后再趁热迅速伸入试管中,可观察到铜丝由黑色变为红色
D. 实验后,可用铝粉在高温下还原玻璃管中的固体获得铁单质
查看答案和解析>>
科目: 来源: 题型:
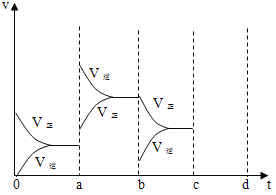
【题目】(1)下图表示在密闭容器中反应:2SO2+O2 ![]() 2SO3 △H =-Q kJ/mol 到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a→b 过程中改变的条件可能是_____;b→c 过程中改变的条件可能是_____; 若增大压强时,将反应速度变化情况画在 c~d 处____________。
2SO3 △H =-Q kJ/mol 到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a→b 过程中改变的条件可能是_____;b→c 过程中改变的条件可能是_____; 若增大压强时,将反应速度变化情况画在 c~d 处____________。
(2)可逆反应 mA(g)+nB(g)![]() pC(g)达到平衡后,升高温度,B 的转化率变大;当减小压强,C 的体积分数减小。
pC(g)达到平衡后,升高温度,B 的转化率变大;当减小压强,C 的体积分数减小。
①用“>”、“=”或“<”填空:该反应的Δ H_____0,m+n_____p。
②用“增大”“减小”或“不变”填空(其他条件不变):恒容下加入 B,则 A 的转化率_____;升高温度,则平衡时 B、C 的浓度之比 c(B)/c(C)将_____;加入催化剂,平衡时气体混合物的总物质的量_____。
③若 A、C 均为无色气体,B 为红色气体,用“变深”、“变浅”或“不变”填空:恒容下加入 C,平衡混合物的颜色_____;而恒压充入氖气,平衡混合物颜色_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com