
科目: 来源: 题型:
【题目】燃烧产生的尾气中含有一定量的NO。科学家们设计了一种间接电处理法除去其中NO的装置,如下图所示,它可以将NO转化为NH4+。下列说法正确的是
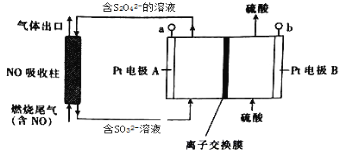
A. a连接电源的正极
B. Pt电极B上发生的电极反应为2H2O-4eˉ=O2↑+4H+
C. 当NO吸收柱中产生1mol SO32ˉ时,理论上处理的NO气体的体积为8.96L(标准状况)
D. 图中的离子交换膜应为阴离子交换膜
查看答案和解析>>
科目: 来源: 题型:
【题目】向0.1mol·L-1的 NH4HCO3溶液中逐渐加入0.1mol·L-1NaOH溶液时,含氮、含碳粒子的分布情况如图所示(纵坐标是各粒子的分布系数,即物质的量与起始物质的量比值)。根据图像,下列说法不正确的是

A. 开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-=HCO3-+H2O
B. 当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应
C. pH=9.5时,溶液中c(HCO3-)>c(NH3·H2O)>c(NH4+)>c(CO32-)
D. 滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH===(NH4)2CO3+Na2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中错误的是
A. 用酒精作为萃取剂从溴水中提取溴
B. 分液时,下层液体下端流出,上层液体上口倒出
C. 蒸馏时,温度计的水银球应位于蒸馏烧瓶的支管口附近
D. 过滤时,漏斗的下端要紧靠烧杯的内壁
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19g/cm3
质量分数:36.5%
(1)该浓盐酸中HCl的物质的量浓度为__________molL-1。
(2)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.200molL-1的稀盐酸。可供选用的仪器有:A胶头滴管;B量筒;C烧杯;D天平;E玻璃棒。
①配制稀盐酸时,上述仪器中不需要使用的有 (选填字母),还缺少的仪器有__________。
②该学生需要用__________mL量筒量取__________mL上述浓盐酸进行配制。
③配制稀盐酸时,在洗涤操作中,将洗涤液全部移入容量瓶,其目的是__________。
④配制稀盐酸时,在定容操作中,应在距刻度线__________处,改用胶头滴管滴加蒸馏水至液面与__________。
⑤若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”、“偏低”或“无影响”)定容时俯视刻度线__________;定容后经振荡、摇匀、静置,发现液面下降,再加适合的蒸馏水__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】今有反应X(g)+Y(g)![]() 2Z(g) △H<0,若反应开始经t1后达到平衡,又经t2后由于反应条件的改变使平衡破坏,到t3时又达平衡(如图所示),t2~t3曲线变化的原因是
2Z(g) △H<0,若反应开始经t1后达到平衡,又经t2后由于反应条件的改变使平衡破坏,到t3时又达平衡(如图所示),t2~t3曲线变化的原因是
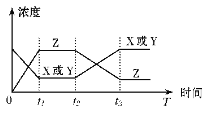
A. 增大了X或Y的浓度
B. 使用了催化剂
C. 增加了反应体系的压强
D. 升高了反应的温度
查看答案和解析>>
科目: 来源: 题型:
【题目】海带中含有丰富的碘元素,某学习小组设计如下实验流程提取海带中的碘,请回答下列问题:
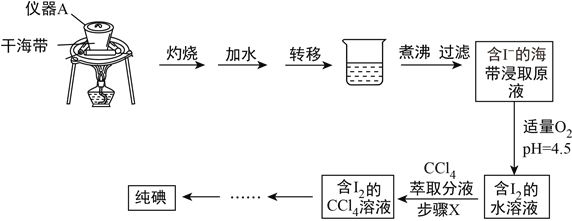
(1)仪器A的名称为__________________,实验室取用仪器A必须使用_________。
(2)煮沸的作用是______________________。
(3)步骤X中,使用了分液漏斗。分液漏斗使用前,须进行的操作是__________;萃取后,分液漏斗内观察到的现象是___________;分液时,为了保证液体顺利留下,应首先_________。
(4)向海带浸取原液中通入适量O2,并控制溶液pH为4.5,此时发生反应的离子反应方程式为:__________________________________________。
(5)某同学欲采用蒸馏含I2的CCl4溶液得到纯碘,此方案不合理,理由是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】胶体区别于其他分散系的本质特征是( )
A.分散质粒子能做无规则运动
B.光线透过时能观察到光亮的通路
C.静置后既不分层,也无沉淀产生
D.分散质粒子直径在10-7~10-9m之间
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取 50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1NaOH 溶液,并用另一温度计测出其温度;③将 NaOH 溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
回答下列问题:
(1)倒入 NaOH 溶液的正确操作是_____(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与 NaOH 溶液混合均匀的正确操作是_____(填序号)。
A.用温度计小心搅拌 B.揭开泡沫塑料板用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动
(3)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和 1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为 ΔH1、ΔH2、ΔH3,则 ΔH1、ΔH2、ΔH3 的大小关系为______________________。
(4)假设盐酸和氢氧化钠溶液的密度都是 1 g·cm-3,又知中和反应后生成溶液的比热容 c=4.18 J·g-1·℃-1。为了计算中和热,某学生记录数据如下:
实验序号 | 起始温度 t1/ ℃ | 终止温度 t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热 ΔH=_____(结果保留一位小数)。_____(填“能”或“不能”)用 Ba(OH)2 溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com