
科目: 来源: 题型:
【题目】某课外探究活动小组使用常用仪器,运用实验室制备氢气的原理,巧妙设计了如图所示的简单实验装置。

甲同学设计了如图甲所示装置:
①检查该装置气密性的方法是_________
②实验时若液面不能与锌粒接触,又无酸液可加,且该装置已固定,则使反应发生的操作是_____
(2)乙同学把试管底部钻一小洞,并和广口瓶组装成如图乙所示具有启普发生器功能的装置,若该装置中的隔板是用铜丝制成的,隔板上放锌粒,酸使用H2SO4,写出反应的离子方程式:_____
(3)丙同学设计了如图丙所示装置,即用橡皮塞代替铁架台来固定试管,则丙同学的做法________(填“可行”或“不可行”),理由是______________
查看答案和解析>>
科目: 来源: 题型:
【题目】缓冲和供氧是维持人体正常生理活动的两个重要平衡系统,回答下列问题:
Ⅰ.人体血液中存在平衡:H2CO3 (aq)![]() H+(aq)+HCO3-(aq) △H,该平衡可使血液的pH维持在一定范围内。
H+(aq)+HCO3-(aq) △H,该平衡可使血液的pH维持在一定范围内。
(1)已知:
CO2(g)![]() CO2(aq) △H1=akJ·mol-l;
CO2(aq) △H1=akJ·mol-l;
CO2(aq)+H2O(l)![]() H2CO3 (aq) △H2=bkJ mol-1;
H2CO3 (aq) △H2=bkJ mol-1;
HCO3-(aq)![]() H+(aq)+CO32-(aq) △H3=ckJ mol-1;
H+(aq)+CO32-(aq) △H3=ckJ mol-1;
CO2(g)+H2O(l)![]() 2H+(aq)+CO32-(aq) △H4=dkJ mol-1。
2H+(aq)+CO32-(aq) △H4=dkJ mol-1。
则上述电离方程式中△H =_____________(用含a、b、c、d的代数式表示)。
(2)若某人血液中c(HCO3-):c(H2CO3)=20:1,pKa1(H2CO3)=6.1,则该人血液的pH=_____________,pH升高,则![]() ___(填“增大”“减小”或“不变”)。
___(填“增大”“减小”或“不变”)。
(3)当有少量酸性物质进入血液后,血液的pH变化不大,用平衡移动原理解释上述现象:_____________。
Ⅱ.肌细胞石储存氧气和分配氧气时存在如下平衡:
Mb(aq)+O2(g)![]() MbO2(aq)。
MbO2(aq)。
肌红蛋白 氧合肌红蛋白
(4)经测定动物体温升高,氧气的结合度[α(MbO2),氧合肌红蛋白的浓度占肌红蛋白初始浓度的百分数]降低,则该反应的△H_______________(填“>”或“<”)0。
(5)温度为37 ℃时,氧气的结合度[α(MbO2)与氧气的平衡分压[p(O2)]关系如下图所示:
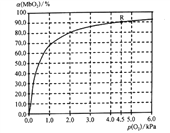
①利用R点所示数据,计算37 ℃时该反应的平衡常数K=_________________(氧气的平衡浓度可用氧气的平衡分压代替求算)。
②已知37 ℃时,该反应的正反应速率v(正)=k1c(Mb)×p(O2),逆反应速率v(逆)=k2c(MbO2),若k2=60s-1,则k1=___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
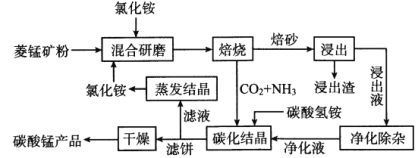
已知:①菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
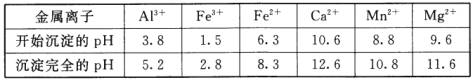
②相关金属离子[c0(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
③常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11。
回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为_________。
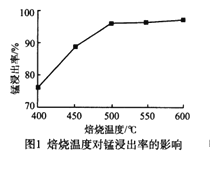
分析下列图1,氯化铵焙烧菱锰矿的最佳条件是:焙烧温度为500℃。分析选择反应温度为500℃的原因_________________。
(2)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为_________;再调节溶液的pH将Al3+、Fe3+变为沉淀除去,溶液pH的范围为_________;然后加入NH4F将Ca2+、Mg2+变为CaF2、MgF2沉淀除去,两种沉淀共存时溶液中![]() =_________。
=_________。
(3)碳化结晶时,反应的离子方程式为_________。
(4)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示,300℃—770℃范围内,发生反应的化学方程式为________________________。
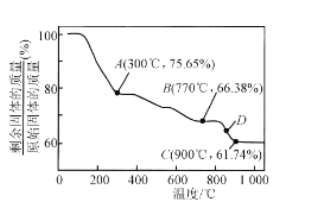
查看答案和解析>>
科目: 来源: 题型:
【题目】联氨(N2H4)常温下为无色液体,可用作火箭燃料。下列说法不正确的是( )
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)= N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=1048.9 kJ·mol-1
A. ΔH4﹦2ΔH32ΔH2ΔH1
B. O2(g)+2H2(g)![]() 2H2O(l) ΔH5,ΔH5>ΔH3
2H2O(l) ΔH5,ΔH5>ΔH3
C. 1 mol O2(g)和2 mol H2(g)具有的总能量高于2 mol H2O(g)
D. 联氨和N2O4作火箭推进剂的原因之一是反应放出大量的热
查看答案和解析>>
科目: 来源: 题型:
【题目】将30 mL 0.5 mol·L-1NaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度为
A. 0.3 mol·L-1 B. 0.03 mol·L-1 C. 0.05 mol·L-1 D. 0.04 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学反应能设计成原电池的是( )
A.CaCO3+2HCl═CaCl2+H2O+CO2↑B.BaCl2+Na2SO4═2NaCl+BaSO4↓
C.2NaOH+CO2═Na2CO3+H2OD.Fe+CuCl2═FeCl2+Cu
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)0.5 mol Na2CO3中含有_____个Na+。
(2)等质量的HCl、NH3、CO2、O2四种气体,在相同温度和相同压强条件下,体积最大的是_______。
(3)实验室需要0.50mol·L—1NaCl溶液480mL。
①配制溶液时必需的仪器有:托盘天平(精确到0.1)、药匙、烧杯、玻璃棒、______、胶头滴管以及等质量的几片滤纸。
②配制该溶液需称取NaCl晶体的质量为_______。
③下列操作会使所配溶液浓度偏低的是________。
A 容量瓶洗涤干净后未干燥
B 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
C 定容时俯视刻度线
D 烧杯和玻璃棒未洗涤
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于2 mol氧气的叙述中,正确的是
A. 质量是32 g B. 体积是44.8 L
C. 分子数约为1.204×1024 D. 原子数是2 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】世界瓷都——泉州德化盛产陶瓷,下列说法不正确的是( )
A.国产C919用到的氮化硅陶瓷是新型无机非金属材料
B.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐
C.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点
D.瓷器的青色来自氧化铁(Fe2O3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com