
科目: 来源: 题型:
【题目】同温同压下两个容积相等的贮气瓶,一个装有C2H4气体,另一个装有C2H2和C2H6的混合气体,两瓶内的气体可能不相同的是
A. 物质的量 B. 原子总数 C. 碳原子数 D. 分子数
查看答案和解析>>
科目: 来源: 题型:
【题目】已知0.5L盐酸和硫酸的混合溶液中含有0.1molCl-和0.2molSO42-,则此溶液中H+的物质的量浓度c(H+)为
A. 1mol/L B. 0.5 mol/L C. 0.6 mol/L D. 1.5 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】同温同压下,1 mol H2和1 mol O2,下列有关它们的说法正确的是
A. 质量相同,体积不同 B. 分子数相同,质量不同
C. 体积相同,分子数不同 D. 体积相同,原子数不同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关试剂的保存方法,错误的是( )
A.浓硝酸保存在棕色玻璃试剂瓶中
B.少量钠保存在煤油中
C.氢氧化钠溶液保存在带有玻璃塞的玻璃试剂瓶中
D.新制氯水通常保存在棕色试剂瓶中
查看答案和解析>>
科目: 来源: 题型:
【题目】硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂。制备硝基苯的过程如下:
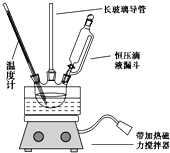
①组装如图反应装置。配制混酸,取100mL烧杯,用20mL浓硫酸与18 mL浓硝酸配制混酸,加入漏斗中,把18 mL 苯加入三颈烧瓶中。
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀。
③在50~60℃下发生反应,直至反应结束。
④除去混酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品。
已知:i.![]() +HNO3(浓)
+HNO3(浓) +H2O
+H2O
![]() +HNO3(浓)
+HNO3(浓)
 +H2O
+H2O
ii可能用到的有关数据列表如下:

(1)配制混酸应在烧杯中先加入___________。
(2)恒压滴液漏斗的优点是_____________。
(3)实验装置中长玻璃管可用_______代替(填仪器名称).
(4)反应结束后,分离混酸和产品的操作方法为_________。
(5)为了得到更纯净的硝基苯,还需先向液体中加入___(填化学式)除去水,然后采取的最佳实验操作是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应A(g)+3B(s) ![]() C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A. v(A)=2 mol·L-1·min-1 B. v(B)=1.2 mol·L-1·s-1
C. v(C)=0.1 mol·L-1·s-1 D. v(D)=0.4 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。下列说法正确的是
A. 标况下,22.4L SO3含氧原子数为3NA
B. CO2 通过 Na2O2 使其增重 bg 时,反应中转移的电子数为 bNA/44
C. 2 molSO2和1 molO2在密闭容器中加热(V2O5催化)充分反应后,容器内分子总数大于2NA
D. 18gD2O和18gH2 O中含有的质子数均为10NA
查看答案和解析>>
科目: 来源: 题型:
【题目】PCl3是磷的常见氯化物,可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其它 | |
黄磷 | 44.1 | 280.5 | 1.82 | 2P+3Cl2(少量) 2P+5Cl2(过量) |
PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl, 遇O2生成POCl3 |
如图是实验室制备PCl3的装置(部分仪器已省略)。

(1)仪器乙的名称是________________________。
(2)实验室用二氧化锰和浓盐酸反应制备Cl2的离子方程式__________________________。实验过程中,为减少PCl5的生成,应控制____________________________________。
(3)碱石灰的作用:一是防止空气中的水蒸气进入而使PCl3水解;二是吸收多余的Cl2,防止污染环境。写出PCl3遇水反应的化学方程式____________________________________。
(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间CO2排尽装置中的空气,其目的是________________________________________________________________________。
(5)测定产品中PCl3纯度的方法如下:迅速称取4.100 g产品,水解完全后配成500 mL溶液,取出25.00 mL加入过量的0.1000 mol·L-120.00 mL碘溶液,充分反应后再用0.1000 mol·L-1Na2S2O3溶液滴定过量的碘,以淀粉溶液作指示剂,终点时消耗12.00 mL Na2S2O3溶液。已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假设测定过程中没有其它反应。滴定终点的现象是:____________________________________________。根据上述数据,该产品中PCl3(相对分子质量为137.5)的质量分数为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】80℃时,NO2(g)+SO2(g)![]() SO3(g)+NO(g)。该温度下,在甲、乙、丙三个体积相等且恒容的密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2 min达平衡时,NO2的转化率为50%,下列说法正确的是
SO3(g)+NO(g)。该温度下,在甲、乙、丙三个体积相等且恒容的密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2 min达平衡时,NO2的转化率为50%,下列说法正确的是
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/(mol·L-1) | 0.10 | 0.20 | 0.20 |
c(SO2)/(mol·L-1) | 0.10 | 0.10 | 0.20 |
A. 容器甲中的反应在前2 min的平均速率v(SO2)=0.10 mol·L-1·min-1
B. 达到平衡时,容器丙中正反应速率与容器甲相等
C. 温度升至90℃,上述反应平衡常数为1.56,则反应的ΔH>0
D. 容器乙中若起始时改充0.10 mol·L-1NO2和0.20 mol·L-1SO2,达到平衡时c(NO)与原平衡相同
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定某烃A的分子组成和结构,对这种烃进行以下实验:
①取一定量的该烃,使其充分燃烧后的气体通过装有CaCl2干燥管,干燥管增重7.2g;再通过石灰水,石灰水增重17.6g。
②经测定,该烃(气体)在标准状况下的密度为1.25g·L-1。
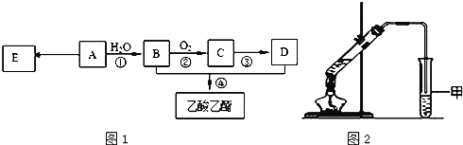
现以A为主要原料合成乙酸乙酯,其合成路线如图1所示。
(1)0.1mol该烃A能与 _____g溴发生加成反应;加成产物需 _____mol溴蒸气完全取代;
(2)B中官能团的名称是_____, B可通过加入强氧化剂为_______(任填一种)一步直接氧化为D。
(3)E是常见的高分子材料,写出E的结构简式______;合成E的反应类型______;
(4)某同学用如图2所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
①实验开始时,试管甲中的导管不伸入液面下的原因是__________;
②上述实验中饱和碳酸钠溶液的作用是________;
③在实验室利用B和D制备乙酸乙酯的实验中,若用1molB和1molD充分反应,不能生成1mol乙酸乙酯,原因是_____。
(5)比乙酸乙酯相对分子质量大14的酯有_____种结构。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com