
科目: 来源: 题型:
【题目】思维辨析:
(1)重结晶仅适用于固体有机物的分离和提纯。(_____)
(2)可以用酒精作萃取剂萃取溴水中的溴。(_____)
(3)萃取法只适用于从液体中萃取物质。(_____)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各物质的分类、名称(俗名)、化学式都正确的是( )
A.碱性氧化物 氧化铁 FeO
B.酸性氧化物 碳酸气 CO2
C.酸 硫酸 H2SO3
D.盐 纯碱 NaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】丙烯是重要的有机化工原料,主要用于生产聚丙烯、丙烯腈、环氧丙烷等.
Ⅰ.(1)以丁烯和乙烯为原料反应生成丙烯的方法被称为“烯烃歧化法”,反应为:C4H8(g)+C2H4(g)![]() 2C3H6(g)。已知:
2C3H6(g)。已知:
①C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H 1=-1411KJmol-1
②C3H6(g)+![]() O2(g)═3CO2(g)+3H2O(l)△H 2=-2049KJmol-1
O2(g)═3CO2(g)+3H2O(l)△H 2=-2049KJmol-1
③C4H8(g)+6O2(g)═4CO2(g)+4H2O(l)△H 3=-2539KJmol-1
“烯烃歧化法”的反应的热化学方程式为_____________________。
(2)一定温度下,在一体积恒为 V 升的密闭容器中充入一定量的 C4H8 和 C2H4,发生烯烃歧化法的 主要反应。 t1 时刻达到平衡状态,此时容器中 n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=b mol, 且 C3H6 占平衡总体积的 1/4。
①求该时间段内的反应速率 v(C4H8)=_____________。 (用只含 a、V、t1 的式子表示)
②判断该反应达到平衡的标志是______________
A.2v (C4H8) 生成=v (C3H6) 消耗
B.C4H8、C2H4、C3H6 的物质的量之比为 1:1:2
C.混合气体的平均相对分子质量不再改变
D.C4H8、C2H4、C3H6 的浓度均不再变化
(3)Kp 是用反应体系中气体物质的分压来表示的平衡常数,即将 K 表达式中平衡浓度用平衡分压代替。已知反应﹕C4H8(g)+C2H4(g)![]() 2C3H6(g),该反应中正反应速率v 正=k 正·p(C4H8)·p(C2H4),逆反应速率 v 逆=k 逆·p2(C3H6),其中 k 正、k 逆 为速率常数,则 Kp 为_________(用 k 正、k 逆表示)。
2C3H6(g),该反应中正反应速率v 正=k 正·p(C4H8)·p(C2H4),逆反应速率 v 逆=k 逆·p2(C3H6),其中 k 正、k 逆 为速率常数,则 Kp 为_________(用 k 正、k 逆表示)。
Ⅱ.“丁烯裂解法”是另一种重要的丙烯生产法,但生产过程中会有生成乙烯的副反应发生.反应如下主反应:3C4H8![]() 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8![]() 2C2H4
2C2H4
测得上述两反应的平衡体系中,各组分的质量分数(w%)随温度(T)和压强(P)变化的趋 势分别如图 1 和图 2 所示:
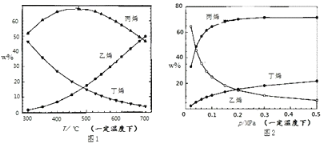
(1)平衡体系中的丙烯和乙烯的质量比是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图 1 和图 2 中表现的趋势来看,下列反应条件最适宜的是_____(填字母序号).
A.300oC 0.1MPa B.700oC 0.1MPa C.300oC 0.5MPa D.700oC 0.5MPa
(2)有研究者结合图 1 数据并综合考虑各种因素,认为 450℃的反应温度比 300℃或 700℃更合适, 从反应原理角度分析其理由可能是________________.
(3)图2中,随压强增大平衡体系中丙烯的百分含量呈上升趋势,从平衡角度解释其原因是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,175℃时分解。
Ⅰ.用硝酸氧化法制备草酸晶体并测定其纯度,制备装置如图所示(加热、固定等装置略去)。
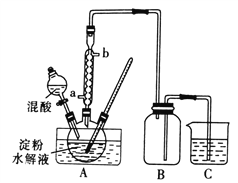
实验步骤如下
①糖化:先将淀粉水解为葡萄糖;
②氧化:在淀粉水解液中加入混酸(质量之比为3:2的65%HNO3与98%HSO4的混合物),在55~60℃下水浴加热发生反应;
③结晶、蒸发、干燥:反应后溶液经冷却、减压过滤,即得草酸晶体粗产品。
(1)装混酸的仪器名称为________;步骤②中,水浴加热的优点为__________。
(2)“②氧化”时发生的主要反应如下,完成下列化学方程式:
___C6H12O6+___HNO3 ![]() ___H2C2O4+9NO2↑+3NO↑+ ______
___H2C2O4+9NO2↑+3NO↑+ ______
(3)称取mg草酸晶体粗产品,配成100mL溶液。取20.00mL于锥形瓶中,用amoL·L-1KMnO4标准液标定,只发生
5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O反应,消耗KMnO4标准液体积为VmL,则所得草酸晶体(H2C2O4·2H2O)的纯度为___________。
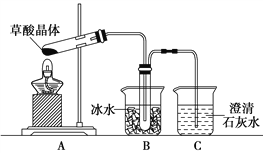
Ⅱ.证明草酸晶体分解得到的产物
(4)甲同学选择下述装置验证产物CO2,装置B的主要作用是__________。
(5)乙同学认为草酸晶体分解的产物中除了CO2、H2O应该还有CO,为进行验证,选用甲同学实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。
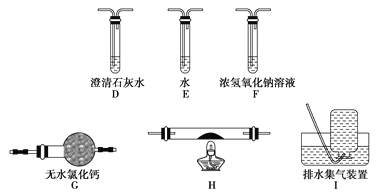
①乙同学的实验装置中,依次连接的合理顺序为A、B、_____________。其中装置H反应管中盛有的物质是________________________。
②能证明草酸晶体分解产物中有CO的现象是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应:3A(g)+B(g)===2C(g)+2D(g),在不同条件下,用不同物质表示其反应速率,分别为①v(A)=0.6 mol·L-1·min-1
②v(B)=0.45 mol·L-1·min-1
③v(C)=0.015 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·min-1,
则此反应在不同条件下进行最快的是( )
A. ②③B. ①③C. ②④D. ②
查看答案和解析>>
科目: 来源: 题型:
【题目】金属铟主要用于生产液晶显示器和平板屏幕。从LCD废料(主要成分是含铟、锡的氧化物)中回收铟的工艺流程如下:
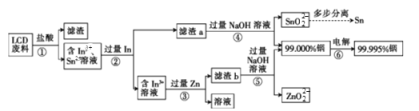
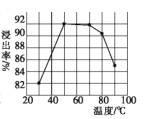
(1)步骤①中用盐酸酸浸时浸出率随温度变化关系如图所示,则最适宜的温度是___________,温度升高浸出率下降的原因是__________
(2)酸浸时铟的氧化物转化成In3+的离子方程式是__________
(3)提纯粗铟的方法和铜的精炼原理相似,则粗铟为__________(填“阴极”或“阳极”),写出阴极的电极反应式: ______________________________
(4)步骤④中所发生氧化还原反应的氧化剂是__________(填化学式),步骤⑤中所发生氧化还原反应的氧化产物与还原产物系数之比是__________
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,可逆反应A(气)+3B(气)![]() 2C(气)若达到平衡的标志是( )
2C(气)若达到平衡的标志是( )
A. C的生成速率与B的生成速率相等B. 混合气体的平均相对分子质量不变
C. 单位时间内生成nmolA,同时生成3nmolBD. A、B、C的分子数之比为1:3:2
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温恒容的容器中进行反应 2SO3(g)![]() 2SO2(g)+O2(g),若反应物浓度由1 mol/L降到0.8 mol/L需10s,那么由0.8 mol/L降到0.4 mol/L,需反应的时间为
2SO2(g)+O2(g),若反应物浓度由1 mol/L降到0.8 mol/L需10s,那么由0.8 mol/L降到0.4 mol/L,需反应的时间为
A. 等于10sB. 小于10sC. 等于20sD. 大于20s
查看答案和解析>>
科目: 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。下列叙述不正确的是( )
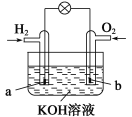
A.a极是负极,该电极上发生氧化反应
B.b极反应是O2+4OH--4e-===2H2O
C.总反应方程式为2H2+O2===2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com