
科目: 来源: 题型:
【题目】在一定条件下,CO和CH4燃烧的热化学方程式为:CO(g)+1/2O2=CO2(g);△H=-283KJ/mol
CH4(g)+2O2=CO2(g)+2H2O(g);△H=-890KJ/mol,现有4mol CO和CH4组成的混合气体在上述条件下完全燃烧时,释放的热量为2953KJ,则CO和CH4的体积比
A. 1:3 B. 3:1 C. 1:2 D. 2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验的实验操作、实验现象和实验结论都正确的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 室温下,向铝箔上滴加浓硫酸 | 无明显现象 | 铝与浓硫酸不反应 |
B | 将二氧化硫通入紫色石蕊试液 | 先变红后褪色 | 二氧化硫是酸性氧化物,还具有漂白性 |
C | 在氯化银悬浊液中滴加少量KBr稀溶液 | 白色浑浊变为淡黄色浑浊 | Ksp(AgCl)>Ksp (AgBr) |
D | NaAlO2溶液中滴加 NaHCO3溶液 | 产生白色沉淀 | N aAlO2和Na HCO3发生相互促进的水解反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.反应的热化学方程式的书写中,ΔH的大小与化学计量数无关
B.ΔH <0、ΔS <0的反应在高温时能自发进行
C.实验室欲快速制取氢气,可利用粗锌与稀硫酸反应
D.金属表面镀银时,应把镀件作为电镀池的阳极
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭烧瓶中,25 ℃时存在着平衡:2NO2(g)![]() N2O4(g)(正反应放热)。把烧瓶置于100 ℃的水中,则下列几项性质中不会改变的是
N2O4(g)(正反应放热)。把烧瓶置于100 ℃的水中,则下列几项性质中不会改变的是
①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度
A. ①和③ B. ②和④ C. ④和⑤ D. ③和⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 14gC2H4含有的单键数目为3NA
B. 99℃时,1LpH=6的纯水中,含有的OH-数目为1×10-8NA
C. 足量的Na与1molO2充分反应,转移的电子数目一定为2NA
D. 8.0gCu2S和CuO的混合物中含有的铜原子数为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2SO3是常见的一种盐,工业上可作防腐剂、去氯剂和还原剂。
(1)Na2SO3固体隔绝空气加强热,反应后的固体中含有S2-。反应的化学方程式为________________;若有0.5molNa2SO3参加反应,则电子转移个数为_____________________。
(2)将0.1mol/L Na2SO3溶液先升温再降温,测定温度变化过程中的pH,数据如下:
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
①时刻Na2SO3溶液中水的电离程度_______同温下纯水中水的电离程度(填)“>”、“<”或“=”);应用平衡原理解释该原因_________________________________。④的pH略小于①,是由于______________________。设计一个简单实验来证明_____________________。
(3)将Na2SO3溶液中所有离子浓度由大到小排列_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度, | 0~3s内,反应速率为: | t1时仅加入催化剂, | 达平衡时,仅改变x,则x为c(O2) |
查看答案和解析>>
科目: 来源: 题型:
【题目】晶体硅是良好的半导体材料,多晶硅主要采用SiHCl3还原工艺生产。
(1)硅原子核外有_____种能量不同的电子。氯离子的核外电子排布式为________________________。短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是________。
(2)从原子结构角度解释硅元素与氯元素的非金属性强弱________________________。
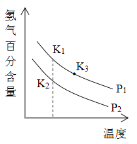
(3)900℃以上发生SiHCl3(g)+H2(g)![]() Si(s)+3HCl(g)反应,平衡时H2的百分含量随温度、压强(P)变化如图(K为不同条件时得平衡常数)。从化学反应速率角度来说明上述反应已达到平衡状态_______。
Si(s)+3HCl(g)反应,平衡时H2的百分含量随温度、压强(P)变化如图(K为不同条件时得平衡常数)。从化学反应速率角度来说明上述反应已达到平衡状态_______。
(4)若反应容器的容积为2L,10min后达到平衡,测得固体的质量增加了2.8g,则HCl的平均反应速率为______________。
(5)P1____P2(选填“>”、“<”或“=”);K1、K2、K3大小关系式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知2H2(g)+O2(g)=2H2O(l) ΔH=-569.6kJ/mol,2H2O(g)=2H2(g)+O2(g) ΔH=+482.1 kJ/mol。现有1g液态H2O,蒸发时吸收的热量是 ( )
A. 2.43 kJ B. 4.86 kJ C. 43.8 kJ D. 87.5 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】芳香族化合物A(其中R是未知基团)在一定条件下可转化成如下系列物质。

(1)写出A的结构简式______________________________。
(2)检验反应②是否完全的方案是___________________________。
(3)C有多种同分异构体,其中含苯环的同分异构体中可能含有的官能团是________。
a.1个酯基 b.2个醛基 c.1个碳碳双键和1个醛基 d.1个醛基和1个羟基
(4)反应①反应类型是________________________。写出反应③的化学方程式__________________________。
(5)E可以合成高聚物,写出该高聚物的结构简式______________________。
(6) 以本题中的C为原料制备![]() ,写出合成路线,无机试剂任选________________________。
,写出合成路线,无机试剂任选________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com