
科目: 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1]:
2NH3(g) ΔH=-92.4 kJ·mol-1]:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
下列说法正确的是
A. 2c1>c3 B. a+b=92.4 C. 2p2<p3 D. α1+α3>1
查看答案和解析>>
科目: 来源: 题型:
【题目】将木炭磨成直径为10nm左右的炭粒后再分散到某液体分散剂中,对所得分散系的叙述正确的是( )
①一定是溶液 ②有丁达尔效应 ③能全部透过半透膜 ④可以全部透过滤纸
A.①②B.②③C.②④D.③④
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) △H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器中进行以上的反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g) △H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器中进行以上的反应(此条件下为可逆反应),下列叙述正确的是
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C. 反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min
D. 当反应吸热为0.025QkJ时,生成的HCl与100mL1mol·L-1的NaOH溶液恰好反应
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示的装置,电源为Zn-MnO2干电池,其电解质溶液是ZnCl2-NH4Cl混合溶液。X、Y都是惰性电极。将电源接通后,向甲中滴入酚酞溶液,在Fe极附近显红色。试回答下列问题:

(1)在电源中,B电极为________极(填“正极”或“负极”);该极的电极反应是____________。
(2)甲装置中总的化学方程式是______________________________________________。
(3)丙装置在通电一段时间后,X电极上发生的电极反应式是________________________。
(4)如果乙装置中精铜电极的质量增加了0.64g,请问甲装置中,铁电极上产生的气体在标准状况下为___L。
(5)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+ Y(g)![]() 2Z(g) △H<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A. 该温度下此反应的平衡常数K = 1.44
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 反应前2 min的平均速率v(Z) = 2.0×10-3 mol/(L·min)
D. 其他条件不变,再充入0.2 mol X,平衡时Y的体积分数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。

(1)A的原子序数为26,A元素在周期表中的位置:______,写出NaOH 的电子式:_____。
(2)写出检验D中阳离子的操作方法为_________________________。
(3)保存C溶液时要加固体A的原因是______________。
(4)写出下列转化的方程式:
①B→C的离子方程式:______________________________。
②E→F的化学方程式:_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】C、H、O三种元素在人体内质量分数约为73%左右,而在组成岩石圈的化学成分中还不到1%,这一事实说明了( )
A. 生物界与非生物界具有相似性
B. 生物界与非生物界的元素组成是不同的
C. 生物界与非生物界具有统一性
D. 生物界与非生物界存在差异性
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向10mL 0.1 mol·L-1的HR溶液中逐滴滴入0.1 mol·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析不正确的是
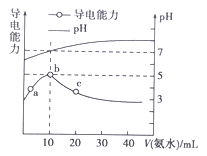
A. b点溶液pH=5,此时酸碱恰好中和
B. a~b点导电能力增强,说明HR为弱酸
C. c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
D. b~c任意点溶液均有c(H+)·c(OH-)=Kw=1.0×10-14
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应H2(g) + I2(g)![]() 2HI(g),在恒温时由H2(g)和I2(g)开始反应,下列说法正确的是
2HI(g),在恒温时由H2(g)和I2(g)开始反应,下列说法正确的是
A. H2(g)的消耗速率与HI(g)的生成速率比为2:1
B. 增大压强(通过改变体积实现),混合气体的颜色不变
C. 正、逆反应速率的比值是恒定的
D. 达到平衡时,用同种物质表示的正、逆反应速率相等
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com