
科目: 来源: 题型:
【题目】已知CeO2通常既不溶于强酸,也不溶于强碱。某工厂以平板电视显示屏厂的废玻璃粉末(含CeO2、SiO2、Fe2O3、FeO等物质)为原料,设计如下图所示工艺流程,制得纯净的CeO2。下列说法正确的是( )

A. 实验室中,操作3和操作1、操作2所用仪器不同
B. 滤渣中加入稀H2SO4和H2O2,其中H2O2做氧化剂
C. 滤液中Ce3+与NaOH、O2的反应属于化合反应
D. 操作2分离得到的滤渣中一定含有未反应的SiO2
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,从A处通入新制备的氯气,关闭旋塞B时,C处红色布条无明显的变化,打开旋塞B 时,C处红色布条逐渐褪色。由此可判断D瓶中装的试剂不可能是

A. 浓硫酸B. 溴化钠溶液C. Na2SO3溶液D. 硝酸钠溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】生命活动的主要承担者、遗传信息的携带者、细胞壁的主要成分的单体依次为()
A. 氨基酸、核苷酸、果糖 B. 蛋白质、DNA、五碳糖
C. 蛋白质、核酸、纤维素 D. 氨基酸、核苷酸、葡萄糖
查看答案和解析>>
科目: 来源: 题型:
【题目】向 100mL1.5mol/L 的 NaOH 溶液中缓慢通入一定量的 CO2 ,充分反应后,向所得溶液中逐滴缓慢滴加稀盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示。
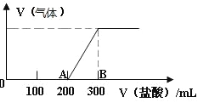
(1)通入一定量的 CO2 充分反应后的溶液中溶质为______(写化学式)
(2)AB 段所发生的离子方程式:______。
(3)滴加稀盐酸的物质的量浓度为______mol/L。
(4)通入二氧化碳的体积为____L(在标准状况下)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将0.1molCH3COONa和0.05molHCl溶于水配成1L溶液(pH<7).
(1)用离子方程式表示该溶液中存在的三个平衡体系______________、_______________、___________________
(2)溶液中各离子的物质的量浓度由大到小顺序为_____________________________________________________
(3)溶液中粒子中浓度为0.1mol/L的是________________,浓度为0.05mol/L的是____________________
(4)物质的量之和为0.lmol的两种粒子是______________与__________
(5)CH3COO-和OH-的物质的量之和比H+多________mol
查看答案和解析>>
科目: 来源: 题型:
【题目】根据要求填空:
(1)FeSO4可转化为FeCO3,FeCO3在空气中加热可制得铁系氧化物材料。已知25℃,101kPa时:4Fe(s)+3O2(g)
=2Fe2O3(s)ΔH=-1648kJ/mol,C(s)+O2(g)=CO2(g) ΔH=-393kJ/mol,2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480kJ/mol,FeCO3在空气中加热反应生成Fe2O3的热化学方程式为_______。
(2)一定条件下,向容积可变的密闭容器中通入N2和H2,发生反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0达到平衡后,试回答下列问题:
2NH3(g) ΔH<0达到平衡后,试回答下列问题:
①达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将____(填“向逆反应方向”、“向正反应方向”或“不”)移动,平衡常数K将_____ (填“增大”、“减小”或“不变”)。
②达到平衡后,在恒压条件下,向容器中通人氦气(He),氮气的转化率将___(填“增大”、“减小”或“不变”)。
(3)AlCl3溶液加热蒸干并灼烧最终得到物质是________(填化学式),将NaHCO3与Al2(SO4)3溶液混合后可做泡沫灭火剂,其原理是_______(用离子方程式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
温度/℃ | 400 | 500 | 850 |
平衡常数 | 9.94 | 9 | 1 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为________,该反应的Q________0(填“>”或“<”)。

(2)850 ℃时在体积为10 L反应器中,通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)浓度变化如图所示,则0~4 min时平均反应速率v(CO)=________。
(3)若在500 ℃时进行,且CO、H2O(g)的起始浓度均为0.020 mol·L-1,该条件下,CO的最大转化率为________。
(4)若在850 ℃时进行,设起始时CO和H2O(g)共为1 mol,其中水蒸气的体积分数为x,平衡时CO的转化率为y,试推导y随x变化的函数关系式为________。
(5)有人提出可以设计反应2CO=2C+O2(ΔH>0)来消除CO的污染。请判断上述反应能否自发进行:____ (填“可能”或“不可能”),理由是____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:

(1)下图中______(填“A”或“B”)是碱式滴定管,进行该实验的第一步操作是____________________。
(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到因加入一滴盐酸后,出现____________________________________(填“现象”)说明达到滴定终点。
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是(____)
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为________mL。

(5)某学生根据3次实验分别记录有关数据如下表:
滴定次数 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.00 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 |
第三次 | 25.00 | 0.22 | 26.31 |
依据上表数据计算该NaOH溶液的物质的量浓度__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】营养专家认为菠菜中铁的含量较高,缺铁性贫血患者多食用菠菜,对疾病的治疗有一定的疗效。你认为菠菜所影响的缺铁性贫血患者合成的化合物名称,及最终决定菠菜含铁量较高的化合物分别是( )
A. 血浆蛋白、核酸 B. 血红蛋白、核酸 C. 血浆蛋白、载体 D. 血红蛋白、载体
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与人类生活密切相关。请按要求,回答下列问题:
(1)K2FeO4 是一种重要的净水剂,可用下列方法制得:2Fe(OH)3 + 3Cl2 + 10KOH![]() 2K2FeO4 + 6KCl + 8H2O在该反应中,还原剂是____________,当反应中有 1mol K2FeO4 生成时,转移电子的数目为___________。
2K2FeO4 + 6KCl + 8H2O在该反应中,还原剂是____________,当反应中有 1mol K2FeO4 生成时,转移电子的数目为___________。
(2)将铜片投入盛有稀硫酸的试管中无反应,当加入少量硝酸钾晶体后,铜片溶解。试用离子方程式表示其中的原因____________。
(3)新制氯水在阳光照射下产生无色气体,该反应的化学方程式是_____。
(4)生产中,人们曾用浓氨水来检验氯气管道是否漏气。如果氯气管道某处漏气,用浓氨水检查时就会产生白烟的现象。若知此反应为有氮气生成的置换反应,则化学方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com